
【题目】氢气是一种理想的绿色能源。利用生物发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:
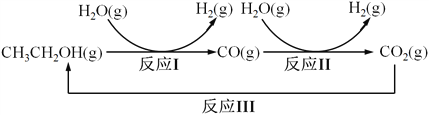
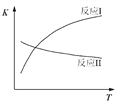
已知:反应I和反应II的平衡常数随温度变化曲线如图所示。
(1)反应I中,1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ。
① H2O的电子式是:_________________。
② 反应I的热化学方程式是:___________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
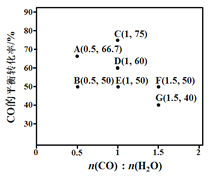
① 图中D、E两点对应的反应温度分别为TD和TE。判断:TD_______TE(填“<” “=”或“>”)。
② 经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的____相同。
③ 当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是______。
(3)反应III,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如下图所示。
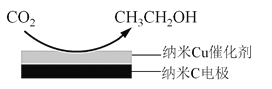
① 阴极的电极反应式是__________________________。
② 从电解后溶液中分离出乙醇的操作方法是______________。
【答案】![]() CH3CH2OH(g) + H2O(g) === 4H2(g) + 2CO(g) △H = +256 kJ·mol-1 < 化学平衡常数 进气比越大,反应温度越低 14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3- 蒸馏
CH3CH2OH(g) + H2O(g) === 4H2(g) + 2CO(g) △H = +256 kJ·mol-1 < 化学平衡常数 进气比越大,反应温度越低 14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3- 蒸馏
【解析】
(1)① H2O的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
② 1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ,根据图像,反应I随着温度升高,平衡常数增大,说明正反应为吸热反应,因此热化学方程式为CH3CH2OH(g) + H2O(g) === 4H2(g) + 2CO(g) △H = +256 kJ·mol-1,故答案为:CH3CH2OH(g) + H2O(g) === 4H2(g) + 2CO(g) △H = +256 kJ·mol-1;
(2)①根据图像,反应II随着温度升高,平衡常数减小,说明正反应放热反应,升温平衡逆向进行,CO转化率减小,图中D、E两点对应的反应温度分别为TD和TE.D点CO转化率大于E点CO转化率,说明TD<TE ,故答案为:<;
②E点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量 1 100
变化量 0.50.50.50.5
平衡量 0.50.50.50.5
K=1
A点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量 1200
变化量![]()
![]()
![]()
![]()
平衡量![]()
![]()
![]()
![]()
K=1
G点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量3200
变化量1.21.21.21.2
平衡量1.80.8121.2
K=![]() =1,
=1,
A、E和G三点对应的化学平衡常数相同,因此反应温度相同,故答案为:化学平衡常数;
③ 已知CO(g)+H2O(g)CO2(g)+H2(g)△H=-42kJmol-1,反应为放热反应,升温平衡逆向进行,CO转化率减小,当不同的进气比达到相同的CO平衡转化率时,图中B、E两点E点的进气比大于B点,但转化率相同,因此需要平衡正向移动,则E点温度低于B点,即进气比越大,反应温度越低,故答案为:进气比越大,反应温度越低;
(3)① 根据图示,阴极发生还原反应,二氧化碳得到电子生成乙醇,根据题意,同时生成HCO3-,电极反应式为14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3-,故答案为:14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3-;
② 乙醇乙挥发,可以通过蒸馏的方法从电解后溶液中分离出乙醇,故答案为:蒸馏。


科目:高中化学 来源: 题型:
【题目】有机物J是我国自主成功研发的一种新药。合成J的一种路线如图:
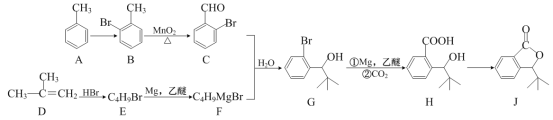
(1)由A生成B的反应所需的试剂及反应条件为___。
(2)由B生成C的反应类型为___。
(3)D___(填写“存在”或“不存在”)顺反异构现象。
(4)C与新制氢氧化铜反应的化学方程式为___(该条件下苯环上的溴不参与反应)。
(5)写出同时满足下列条件的J的一种同分异构体的结构简式___。
①分子中除苯环外不含其它环状结构;
②能发生银镜反应;
③分子中只含有有2种不同化学环境的氢。
(6)写出以乙醇和乙酸为原料制备![]() 的合成路线图___(无机试剂和乙醚任用,合成路线图示例见本题题干)。
的合成路线图___(无机试剂和乙醚任用,合成路线图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为 2L 的恒容密闭容器中,A、B、C、D 四种气体物质发生可逆反应,其物质的量 n(mol)随时间 t(min)的变化曲线如图所示。回答下列问题:

(1)该反应的化学方程式为____。
(2)前 2min 内用 A 的浓度变化表示的化学反应速率为____;
(3)在 2min 时,图象发生改变的原因可能是_____ (填字母)
A.增大 B 的物质的量 B.降低温度 C.加入催化剂 D.减小 A 的物质的量
(4)不同条件下的该反应的速率:①v(A)=1.0mol·L-1·s-1,②v(B)=1.0 m ol·L-1·s-1,③v(C)=1.2 mol·L-1·s-1,④v(D)=1.2mol·L-1·s-1。其中反应速率最快的是___ (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 在蒸馏水中加入NH4NO3固体,Kw不变
B. 加水稀释FeCl3溶液,c(Fe3+)/ c(Cl-)的值减小
C. 加热蒸干并灼烧Al(NO3)3溶液得到Al(OH)3固体
D. 浓度均为0.1 mol·L-1的Na2CO3和NaHCO3的混合溶液中:3c(Na+)=2[c(CO32- )+c(HCO3-)+ c(H2CO3)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对气体A样品进行如下实验:①将样品溶于水,发现气体A易溶于水;②将A的浓溶液与MnO2 共热,生成一种黄绿色气体单质B,B通入石灰乳中可以得到漂白粉。
(1)写出A、B的化学式:A____________,B_______________。
(2)写出A的浓溶液与MnO2 共热的化学方程式:_________________________。
(3)写出B通入石灰乳中制取漂白粉的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列物质在20℃下的Ksp如下,
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
下列说法不正确的是
A. 20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S。
B. 向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br -) /(Cl -)=2.7×10-3
C. 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是K2CrO4
D. 某溶液中含有Cl-、Br-和I-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,Cl-最先沉淀出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反应过程示意图如下:
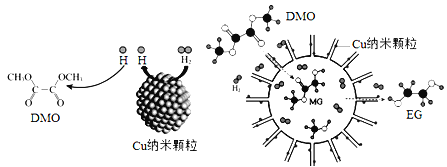
下列说法不正确的是
A. Cu纳米颗粒将氢气解离成氢原子
B. 1mol DMO分子进行水解可以得到1mol甲醇
C. 反应过程中生成了MG和甲醇
D. EG和甲醇不是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质。
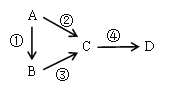
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式_________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com