
| A.钠在空气中燃烧生成淡黄色的Na2O2 |
| B.将SO2通入过量BaCl2溶液可生成BaSO3沉淀 |
| C.新制氯水显酸性,向其中滴加少量紫色石蕊试液,振荡后溶液最终呈红色 |
| D.点燃的镁条插入盛有CO2的集气瓶中,立即熄灭 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
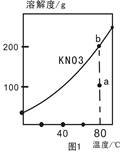
| A.图1表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点 |
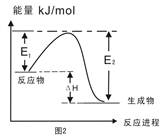
| B.图2表示某一放热反应,若使用催化剂E1、E2、ΔH都会发生改变 |
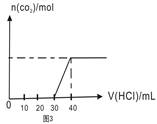
| C.图3表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况 |
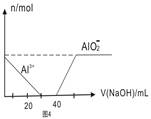
| D.图4表示向100mL0.1mol /L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 在Ba(NO3)2溶液中分别滴入H2SO3及H2SO4溶液 | 均有白色沉淀 | 沉淀均为BaSO4 |
| B | 混合装有Cl2和NH3量集气瓶中的气体 | 产生大量白烟 | NH3显还原性和碱性 |
| C | 溶液X中滴入盐酸酸化的FeCl2溶液,再滴入淀粉溶液 | 溶液变蓝色 | 溶液X中一定含有I- |
| D | 向浓度居委0.01mol/LNaCl和Na2S的混合溶液中滴入少量AgNO3 | 出现黑色沉淀 | Ksp(Ag2S)>Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在使用纯碱溶液清洗油污时,加热可以增强其去污能力 |
| B.液氨汽化时要吸收大量的热,因此氨常做制冷剂 |
| C.向AlCl3溶液中加入过量氢氧化钠溶液,制备氢氧化铝 |
| D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用醋酸除去 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | ⑦ | | | | | | | | | | | | | | | ⑧ | |
| | | | | | | | ⑨ | | | ⑩ | | | | | | | |
查看答案和解析>>
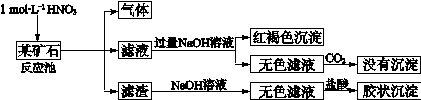
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com