
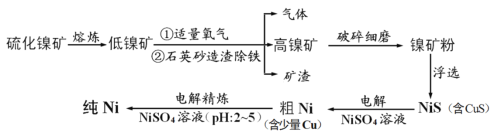
【题目】元素Ni用途广泛,工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
已知:①电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2 -2e-= 2H+ E=0.00V; Cu-2e- =Cu2+ E=0.34V;
Fe -2e-= Fe2+ E=-0.44V; Ni-2e-=Ni2+ E=-0.25V
②常温下溶度积常数 Ksp(NiS)=1.07×10-21; Ksp(CuS)=1.27×10-36
(1)可用光洁的镍丝代替铂丝蘸取化学试剂在焰色反应实验中灼烧,原因是_________。
(2)就制备高镍矿的相关问题请回答:
①通入氧气时控制适量的目的是________________。
②已知矿渣能使酸性高锰酸钾溶液褪色,原因是__________________。
(3)电解制粗镍时阳极发生的主要电极反应式___________________。
(4)电解精炼镍的过程需控制pH为2~5,试分析原因__________________。
(5)工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+) 为0.107 mol/L,则滤液中残留的c(Cu2+)为________ mol/L。
【答案】镍的焰色反应为无色 将部分硫元素转化为SO2除去;防止氧化Fe2+,便于用石英砂造渣除铁 矿渣中含有Fe2+ NiS-2e-=Ni2++S 根据电极电位可知,H+先于Ni2+放电,当pH<2时,c(H+)大,易在阳极放电,当pH>5时,c(OH-)增大,Ni2+易生成Ni(OH)2沉淀 1.27×10-16
【解析】
根据流程:将硫化镍矿(含少量杂质硫化铜、硫化亚铁)熔炼后将部分硫元素以二氧化硫的形式除去,二氧化硫可用于制硫酸,得到低镍矿,加入适量的氧气,用石英造渣除铁得到Fe2SiO4,反应为:SiO2+2FeO![]() 2FeOSiO2,将得到高镍矿浮选出NiS(含CuS),为提高浮选率,将其破碎细磨,将NiS(含CuS)在NiSO4溶液中电解,阳极的反应为:NiS-2e-=Ni2++S、CuS-2e-=Cu2++S,阴极为:Ni2++2e-=Ni,Cu2++2e-=Cu,制得粗Ni含有少量Cu,将粗Ni用NiSO4溶液,控制pH为2~5,电解精炼,粗Ni为阳极,反应为:Ni-2e-=Ni2+,Cu从粗Ni脱落形成阳极泥,阴极为Ni2++2e-=Ni,阴极制得精Ni,据此分析作答。
2FeOSiO2,将得到高镍矿浮选出NiS(含CuS),为提高浮选率,将其破碎细磨,将NiS(含CuS)在NiSO4溶液中电解,阳极的反应为:NiS-2e-=Ni2++S、CuS-2e-=Cu2++S,阴极为:Ni2++2e-=Ni,Cu2++2e-=Cu,制得粗Ni含有少量Cu,将粗Ni用NiSO4溶液,控制pH为2~5,电解精炼,粗Ni为阳极,反应为:Ni-2e-=Ni2+,Cu从粗Ni脱落形成阳极泥,阴极为Ni2++2e-=Ni,阴极制得精Ni,据此分析作答。
(1)镍丝灼烧时火焰呈无色,不影响其他金属元素的焰色,故焰色反应实验可以用光洁的镍丝代替铂丝蘸取化学试剂灼烧;
(2)①通入氧气时控制适量的目的是可以使其中的S元素氧化为SO2气体逸出,同时又防止氧化Fe2+,便于用石英砂造渣除铁;
②已知矿渣能使酸性高锰酸钾溶液褪色,原因是矿渣中含有Fe2+,Fe2+具有还原性,与具有氧化性的酸性高锰酸钾发生氧化还原反应而使酸性高锰酸钾溶液的紫色褪去;
(3)电解制粗镍时阳极上是NiS失去电子,发生氧化反应,主要电极反应式为:NiS-2e-=Ni2++S;
(4)根据电极电位可知,H+先于Ni2+放电,当pH<2时,c(H+)大,易在阳极放电,当pH>5时,c(OH-)增大,Ni2+易生成Ni(OH)2沉淀,所以电解精炼镍的过程需控制pH为2~5;
(5)工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+)为0.107 mol/L,由于Ksp(NiS)=1.07×10-21,则溶液中S2-浓度为c(S2-)=![]() mol/L=1.0×10-20mol/L,根据Ksp(CuS)=1.27×10-36,可知滤液中残留的c(Cu2+)=
mol/L=1.0×10-20mol/L,根据Ksp(CuS)=1.27×10-36,可知滤液中残留的c(Cu2+)=![]() mol/L=1.27 ×10-16mol/L。
mol/L=1.27 ×10-16mol/L。


科目:高中化学 来源: 题型:
【题目】某同学设计如图所示实验,探究反应中的能量变化。
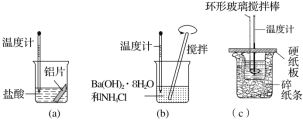
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D.若用NaOH固体测定中和热,则测定中和热的数值偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向容积可变的密闭容器中充入醋酸的二聚物![]() ,发生反应:
,发生反应:![]() 。测得平衡时混合气体的平均摩尔质量
。测得平衡时混合气体的平均摩尔质量![]() 与温度
与温度![]() 、压强
、压强![]() 的关系如图所示。下列有关说法错误的是( )
的关系如图所示。下列有关说法错误的是( )
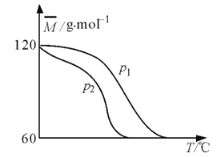
A.![]()
B.当![]() 时,平衡常数
时,平衡常数![]()
C.保持温度不变,增大压强,平衡左移,![]() 增大
增大
D.![]() 条件下,保持温度不变,向容器中加入少量
条件下,保持温度不变,向容器中加入少量![]() ,
,![]() 平衡转化率增大
平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
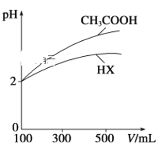
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3 mol/L的AgNO3溶液,乙池为1 mol/L的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是
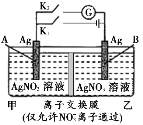
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
B.断开K1、闭合K2,当转移0.1 mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )

A. γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B. α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D. 三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求回答下列问题
(1)硫酸铁溶液显酸性的原因_____(用离子方程式表示).
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显_____性.
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中,c(NH4+)由大到小的顺序_____(填序号).
(4)将化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)B(g)+nC(g),反应到3min时,容器内A的浓度为0.8mol/L,测得这段时间内,平均速率ν(C)=0.6mol/(Lmin),则化学方程式中的n值为_____,ν(B)=_____,此时A的分解率为_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com