
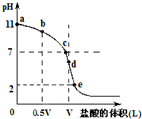
 常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:分析 (1)酸或碱抑制水电离,含有弱离子的盐促进水电离;
(2)温度不变,水的离子积常数、弱电解质的电离平衡常数不变;
(3)未加HCl时,氨水浓度为0.1mol/L,溶液的pH=11,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,水的电离程度较小,溶液中c(OH-)≈c(NH4+),一水合氨电离程度较小,则c(NH3.H2O)≈0.1mol/L.
解答 解:(1)c、b溶液中都含有一水合氨,d点溶液中的溶质是氯化铵,一水合氨抑制水电离且一水合氨浓度越大其抑制程度越大,氯化铵促进水电离,所以水电离的c(OH-)由大到小的顺序为d>c>b,故答案为:d>c>b;
(2)a.溶液体积增大,氨水浓度减小,促进一水合氨电离,则铵根离子物质的量增大、一水合氨物质的量减小,溶液体积相等,所以$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大,故错误;
b.随着反应的进行,溶液碱性减弱,溶液中氢离子浓度增大、氢氧根离子浓度减小,所以$\frac{c({H}^{+})}{c(O{H}^{-})}$增大,故错误;
c.$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$为一水合氨电离平衡常数,温度不变,电离平衡常数不变,故正确;
d.$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$=$\frac{c({H}^{+}).c(O{H}^{-})}{\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}}$=$\frac{{K}_{w}}{{K}_{a}}$,温度不变,水的离子积常数、一水合氨电离平衡常数都不变,所以$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不变,故正确;
故选cd;
(3)未加HCl时,氨水浓度为0.1mol/L,溶液的pH=11,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,水的电离程度较小,溶液中c(OH-)≈c(NH4+),一水合氨电离程度较小,则c(NH3.H2O)≈0.1mol/L,则电离平衡常数=$\frac{1{0}^{-3}.1{0}^{-3}}{0.1}$=10-5,
故答案为:10-5.
点评 本题考查酸碱混合溶液定性判断,为高频考点,知道水电离程度与酸、碱、盐溶液的关系,注意电离平衡常数、水解平衡常数、离子积常数只与温度有关,与溶液酸碱性无关,易错题是(2)d选项.


科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
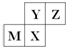
| A. | 四种元素中,最高价氧化物的水化物酸性:Z的最强 | |
| B. | 氢化物稳定性:Y的最强 | |
| C. | 原子半径由小到大顺序:Y<Z<M<X | |
| D. | 同周期元素中M元素原子失电子最多,其单质的还原性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最外层电子数:Y>W | D. | Y、z的氧化物都是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  称取NaOH固体 | B. | 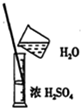 稀释浓硫酸 | ||
| C. | 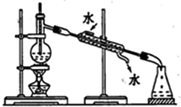 分离乙醇和水混合物 | D. | 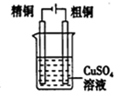 电解炼制铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的同分异构体中,一氯代物仅有一种的有机物一定是2,2一二甲基戊烷. | |
| B. | 若某高分子化合物对应的单体有两种,则此高聚物一定是通过缩聚反应得到的. | |
| C. | 等物质的量的乙烯和乙醇在足量氧气中完全燃烧,消耗O2和生成CO2的量相等 | |
| D. | 苯丙氨酸的结构为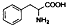 ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com