
����Ŀ��Ԫ�����ڱ��е������ڵĽ���Ԫ���������Ϳ������зdz���Ҫ��ʹ�ü�ֵ��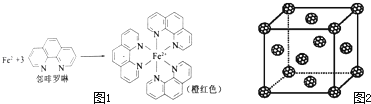
��1���ⶨ���������ĺ���ʱ���Ƚ���������ԭΪ���������ٲ����ڷ���������ɫ�����ñ�ɫ���ⶨ���������к��и�������ʱ��Բⶨ�и��ţ���صķ�Ӧ���£�4FeCl3+2NH2OHHCl��4FeCl2+N2O��+6HCl+H2O
��Fe2+�ڻ�̬ʱ����������Ų�ʽ��
���ǰ��У�NH2OH������SP3�ӻ���ԭ������
��Fe2+���ڷ������γɵ�������У���λ��Ϊ��
��2��������ͭ��Һ�м��������ˮ��Ȼ����������Ҵ�����Һ����������ɫ��[Cu��NH3��4]SO4���壬�þ����к��еĻ�ѧ����������
��3��������ͭ��Һ�м��������ˮ��������[Cu��NH3��4]2+ �� ��֪NF3��NH3�Ŀռ乹�Ͷ��������Σ���NF3 ������Cu2+�γ������ӣ���ԭ������
��4�������Ni��CO��4�����³�Һ̬��������CCl4�������л��ܼ�����̬Ni��CO��4�������壻
��5������Ѿ����������������������Χ�ɵĿ�϶�����������϶���������ڵ縺����С��ԭ�ӿ���Ϊ�������C60 ����Ŀ�϶�У��γɾ������õij����ԵIJ���C60 ������ְ�C60������ʵ㣬�þ���ľ����ṹ��ͼ2��ʾ����ÿ���������϶����һ��ԭ�ӣ���ȫ������C60 ������������϶�����γɵIJ���C60 ������Ļ�ѧʽΪ ��
���𰸡�
��1��ls22s22p63s23p63d6��[Ar]3d6��N��O��6
��2�����Ӽ������ۼ�����λ��
��3��F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ�������γ���λ����NF3������Cu2+�γ�������
��4������
��5��K2C60
����������1��������26��Ԫ�أ���ԭ�Ӻ�����26�����ӣ���ԭ��ʧȥ2�����ӱ���������ӣ�Fe2+�ڻ�̬ʱ����������Ų�ʽΪls22s22p63s23p63d6��[Ar]3d6 �� ���Դ��ǣ�ls22s22p63s23p63d6��[Ar]3d6�����ǰ������У��۲���Ӷ�Ϊ4��ԭ����N��Oԭ�ӣ����Բ���sp3�ӻ���ԭ����N��Oԭ�ӣ����Դ��ǣ�N��O������λ����������λ��������һ���γ���ɼ�����λԭ�ӵ�����������Fe2+���ڷ������γɵ������γɹ�����ͼ1���У���λ��Ϊ6�����Դ��ǣ�6����2��Cu2+�ṩ�չ����Nԭ���ṩ�¶Ե��ӣ�Cu2+��NH3����֮���γ���λ����NH3������N��Hԭ��֮���Թ��ۼ���ϣ��Ƚ�����[Cu��NH3��4]2+���������SO42�������Ӽ���ϣ����Դ��ǣ����Ӽ������ۼ�����λ������3��N��F��H����Ԫ�صĵ縺�ԣ�F��N��H������NH3�й��õ��Ӷ�ƫ��N������NF3�У����õ��Ӷ�ƫ��F��ƫ��Nԭ�ӣ����Դ��ǣ�F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ�������γ���λ����NF3������Cu2+�γ������ӣ���4��Ni��CO��4������ΪҺ̬��������CCl4�������л��ܼ�����̬Ni��CO��4���ڷ��Ӿ��壬���Դ��ǣ����ӣ���5�����������У��ڳ��������Σ�Ȼ������ŵ��ĸ�������Χ�ɵĿ�϶���ͽ����������϶����ͼ��ʾ�� 
�����������ṹ�У�ÿ��С�������Ӧ1���������϶��һ����8�����������϶����ͼ����������һ�����������ڵ縺����С��ԭ����K�����Ծ�����һ����8��Kԭ�ӣ�1+6�� ![]() =4��C60���ӣ������ K8��C60��4 �� ��ѧʽΪK2C60 �� ���Դ��ǣ�K2C60 ��
=4��C60���ӣ������ K8��C60��4 �� ��ѧʽΪK2C60 �� ���Դ��ǣ�K2C60 ��


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������AgCl��s���ֱ����ӵ�����������Һ�У�������Һc��Ag+����С���ǣ�������
A.10 mL 0.4molL��1������
B.10 mL 0.3molL��1 MgCl2��Һ
C.10 mL 0.5molL��1 NaCl��Һ
D.10 mL 0.1molL��1 AlCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ת�������в�����ͨ��һ����Ӧʵ�ֵ��ǣ� ��
A. SiO2��H2SiO3B. CuSO4��CuCl2
C. SiO2��Na2SiO3D. Na2O2��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ���Ͻ����Ӳ�����ɡ����ۡ��ྻ�����ڼӹ�����Ϊ���ͽ���װ����ϣ���Ҫ���������������š��������ȣ���������Щ��;�ص�������(����)
A. �������� B. �����Ժ�
C. �ܶ�С D. ǿ�ȸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1��CH4��CO2 �� ��һ�������·�����ӦCH4��g��+CO2��g��2CO��g��+2H2��g�������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��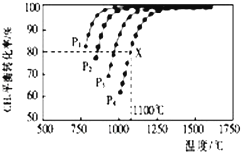
��1����ͼ��֪��p1��p2��p3��p4�ɴ�С��˳������
��2����ѹǿΪp4��1100��C�������£��÷�Ӧ5minʱ�ﵽƽ��X�㣬��Ӧ��ƽ�ⳣ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.��H��0�ķ�Ӧ�����Է���Ӧ
B.�Է����еķ�Ӧһ����Ѹ�ٽ���
C.�����������Զ��ۻ���ˮ�����������Ĺ���
D.����������ȷֽ���һ���ؼ�С�Ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����ԭ���װ��ͼ���ɴ��ж�����˵��������ǣ� �� 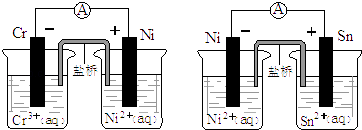
A.�������ת����ͬ����ʱ�����ɺ�����Ni�����ʵ�����ͬ
B.��װ�ù���ʱ�������е����������ƶ����������������ƶ�
C.�ɴ˿��ж��ܹ�����2Cr3++3Ni=3Ni2++2Cr��Ni2++Sn=Sn2++Ni�ķ�Ӧ
D.�ɴ˿��ж�Cr��Ni��Sn���ֽ����Ļ�ԭ��ǿ��˳��Ϊ��Cr��Ni��Sn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. ����������Ԫ�ص�����ϼ�����ֵ�ϲ�һ�������ڸ�Ԫ�������������
B. ���������⣬�������ھ���18��Ԫ��
C. ����Ԫ�����зǽ���Ԫ��
D. �����Ԫ����ָ�ڢ�A�������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ۼ��뵽һ������������������þ�Ļ��Һ�У���ַ�Ӧ����ˣ��������м���ϡ���ᣬ�����ݲ���������������
A.һ������������þ B.����������
C.���ܺ�þ D.ֻ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com