
| A. | pH增大 | B. | c(CH3COOH)增大 | ||
| C. | CH3COOH电离程度增大 | D. | c(H+)×c(OH-)=1×10-14 |
分析 醋酸为弱酸,其电离平衡为吸热反应,若溶液温度从室温升高到60℃,醋酸的电离程度增大,则溶液中氢离子浓度增大,醋酸的浓度减小,醋酸的电离程度增大、溶液的pH减小;温度升高后水的离子积增大,据此进行判断.
解答 解:A.升高温度后醋酸的电离程度增大,溶液中氢离子浓度增大,则溶液的pH减小,故A错误;
B.醋酸的电离为吸热反应,升高温度后醋酸的电离程度增大,醋酸的浓度减小,故B错误;
C.升高温度后促进了醋酸的电离,醋酸的电离程度增大,故C正确;
D.温度升高后水的离子积增大,则c(H+)×c(OH-)>1×10-14,故D错误;
故选C.
点评 本题考查了弱电解质的电离及其影响,题目难度不大,明确温度对电离平衡的影响为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 35.5:108 | B. | 16:207 | C. | 8:1 | D. | 108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NH4Cl溶液与0.05mol/L NaOH溶液等体积混合后所得的碱性溶液中:c(Cl-)>c(Na+)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+) | |
| C. | 等物质的量的NaClO、NaHCO5混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
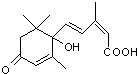 2010春节(虎年)的到来.农艺师对盆栽鲜花施用了S-诱抗素剂(分子结构如图),以使鲜花按时盛开.下列说法不正确的是( )
2010春节(虎年)的到来.农艺师对盆栽鲜花施用了S-诱抗素剂(分子结构如图),以使鲜花按时盛开.下列说法不正确的是( )| A. | S-诱抗素的分子式为C15 H20 O4 | |
| B. | S-诱抗素既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1 mol S-诱抗素最多能和含1 mol NaOH的水溶液发生反应 | |
| D. | S-诱抗素既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.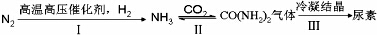
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| C. | 氨水与FeCl3溶液反应:3OH-+Fe3+═Fe(OH)3↓ | |
| D. | NaOH与盐酸反应:OH-+H+═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com