
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| B. | NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,混合溶液中:c(Na+)<c(CH3COO-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=$\frac{1}{2}$c(Na+) |
分析 A.铵根离子部分水解,导致铵根离子的浓度减小;
B.根据碳酸氢钠溶液中的电荷守恒判断;
C.溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-);
D.根据碳酸钠溶液中的物料守恒进行判断.
解答 解:A.NH4Cl为强酸弱碱盐,溶液中存在水解平衡:NH4++H2O?NH3•H2O+H+,溶液呈酸性,则:c(H+)>c(OH-),根据电荷守恒可知c(Cl-)>c(NH4+),故A错误;
B.NaHCO3溶液中,根据电荷守恒可得:c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-),故B错误;
C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-),故C错误;
D.碳酸钠溶液中,根据物料守恒可得:c(HCO3-)+c(H2CO3)+c(CO32-)=$\frac{1}{2}$c(Na+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握盐的水解原理,明确电荷守恒、物料守恒及质子守恒的含义,能够根据电荷守恒、物料守恒及盐的水解原理判断溶液中各离子浓度大小.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | KNO3(NaCl) | H2O | 重结晶 |
| B | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 溴苯(溴) | H2O | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 118号元素属于第八周期元素 | |
| B. | 118号元素是一种金属元素 | |
| C. | 118号元素的原子核中含有118个质子 | |
| D. | 118号元素原子经化学反应后可转化成其他元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
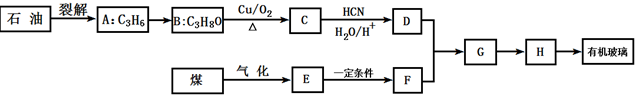
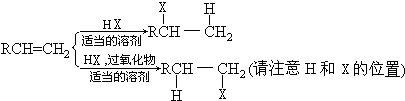
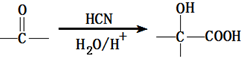
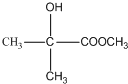 ;有机玻璃的链节是:
;有机玻璃的链节是: ;
;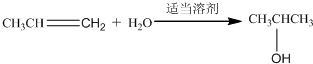 ;
;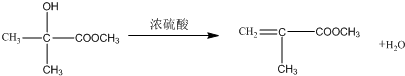 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用稀硫酸代替AgNO3溶液,也可形成原电池 | |
| B. | 银片为负极,发生的反应为:Ag++e-=Ag | |
| C. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| D. | 取出盐桥,电流表依然有偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2、K2CO3 | |
| B. | 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 | |
| C. | 气体A和气体D一定均为纯净物 | |
| D. | 原混合物中一定含有MnO2、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数X>Y | B. | 原子半径X<Y | ||
| C. | X和Y一定同周期 | D. | X是第ⅡA族元素,Y是第VⅡA族元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com