
| A. | 反应①中的两种物质互为同素异形体 | |
| B. | 反应②中HCNO是氧化剂 | |
| C. | 反应②中N2既是氧化产物,又是还原产物 | |
| D. | 反应②中NO2是还原剂 |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后,若只升高温度,化学平衡正向移动 | |
| B. | 达到平衡后,再通入稀有气体,逆反应速率增大 | |
| C. | 使用催化剂,平衡常数不变 | |
| D. | 0~5 min内,NO的反应速率为2.4×1 0-3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
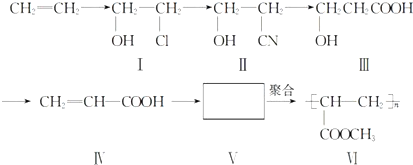
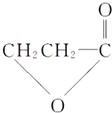 .(提示:该反应的逆反应原子利用率为100%)
.(提示:该反应的逆反应原子利用率为100%)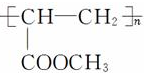 ;
; 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
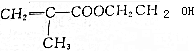 ,下列说法错误的是( )
,下列说法错误的是( )| A. | M能发生加成反应 | |
| B. | M能发生取代反应 | |
| C. | 一定条件下,M能与乙醇发生酯化反应 | |
| D. | M既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com