
| A. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| B. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 | |
| C. | 实验“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25g质量分数为68%的H2O2水溶液中含有的氧原子数目为NA | |
| B. | 标准状况下,11.2LCH3OH中含有的共价键数目为2.5NA | |
| C. | 42g由丙烯(C3H6)和环丙烷(C3H6)组成的混合气体中含有的氧原子数目为6NA | |
| D. | 1L0.1mol•L-1NaHCO3溶液中HCO${\;}_{3}^{-}$和${CO}_{3}^{2-}$数目之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
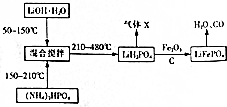
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 条件 |
| ① | K+、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| ② | Cu2+、NO3-、S2-、Cl- | 滴加盐酸立即有气体产生 |
| ③ | NH4+、Fe3+、SO42-、HCOOH | 滴加NaOH浓溶液立刻有气体产生 |
| ④ | Na+、HCO3-、Mg2+、SO42- | 逐滴滴加氨水立即有沉淀产生 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
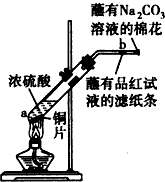 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com