
分析 (1)将3.2g即0.05mol铜粉与过量硝酸(amol/L,30mL),充分反应,根据Cu元素守恒,生成硝酸铜是0.05mol,显示酸性的硝酸的量0.1mol,硝酸根离子为0.1mol,反应后溶液中含H+为0.1mol,所以剩余硝酸是0.1mol,此部分硝酸根离子是0.1mol;
(2)结合电子守恒和N元素守恒计算生成的气体中NO2和NO的物质的量;
(3)由方程式可知,只有NO2,气体能完全被吸收,根据电子转移守恒可知,此时a的值最大,气体为NO和NO2,二者按1:1可以被完全吸收,故气体完全被吸收,应满足n(NO2)≥n(NO),结合(2)中的表达式计算.
解答 解:(1)将3.2g即0.05mol铜粉与过量硝酸(amol/L,30mL),充分反应,根据Cu元素守恒,生成硝酸铜是0.05mol,显示酸性的硝酸的量0.1mol,硝酸根离子为0.1mol,反应后溶液中含H+为0.1mol,所以剩余硝酸是0.1mol,此部分硝酸根离子是0.1mol,所以此时溶液中所含NO3-的物质的量是0.1mol+0.1mol=0.2mol,
故答案为:0.2;
(2)3.2g即0.05mol铜粉失去电子的物质的量:0.05mol(2-0)=0.1mol,反应后溶液中含H+为0.1mol,所以剩余硝酸是0.1mol,消耗的硝酸是(0.03a-0.1)mol,设生成的NO2和NO的物质的量分别是x、y,根据Cu元素守恒,生成硝酸铜是0.05mol,此部分硝酸根离子是0.1mol,剩余硝酸是0.1mol,根据N元素守恒:x+y+0.1=(0.03a-0.1)mol,根据电子守恒:0.1mol=x+3y,联立方程式,解得x=(0.045a-0.35)mol,y=0.015(10-a)mol,
答:生成的NO2和NO的物质的量分别是:(0.045a-0.35)mol,0.015(10-a)mol;
(3)如硝酸全部被还原为NO2,由转移电子数目相等可知,生成的NO2物质的量为n(NO2)=2n(Cu)=2×0.05mol=0.1mol,则0.045a-0.35=0.1,解得a=10,由于为混合气体,故a<10,如生成NO和NO2,气体完全被吸收,则由反应2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O可知,应满足n(NO2)≥n(NO),即:(0.045a-0.35)mol≥0.015(10-a)mol,解得a≥8.3,所以得到a的取值范围:8.3≤a<10,
答:取值范围为8.3≤a<10.
点评 本题考查混合物计算、根据方程式计算,侧重于学生的分析能力和计算能力的考查,判断气体完全吸收满足的条件是关键,属于字母型计算,增大计算难度,为易错题目,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C2H5OH | B. | CH4 | C. | C2H4O | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
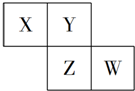 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )| A. | 阴离子的半径从大到小排列顺序为:X>Y>Z>W | |
| B. | X、Y、Z、W元素的氢化物分子间都可以形成氢键 | |
| C. | Y的两种同素异形体在常温下可以相互转化 | |
| D. | 最高价氧化物对应的水化物的酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
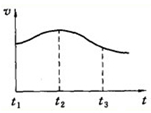 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
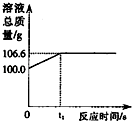 将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:
将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com