
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿,软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分,闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0.1000molL﹣1的标准Na2S2O3溶液滴定,消耗标准液50.00ml,则软锰矿中MnO2含量 。(已知:2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4; I2+2S2O32﹣=2I﹣+S4O62﹣)
Ⅱ.研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图1所示。
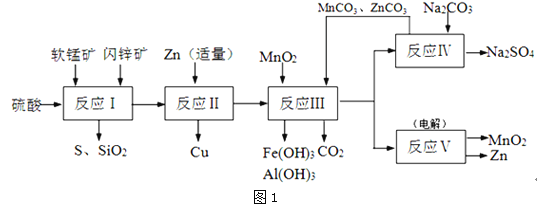
请回答下列问题:
(2)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等.试完成反应I中生成CuSO4和MnSO4的化学方程MnO2+CuS+ = + +CuSO4+MnSO4。
(3)反应Ⅱ加入适量锌的作用是 ;如果锌过量,还会进一步发生反应的离子方程式为 。
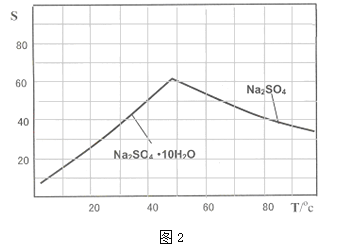
(4)图2是Na2SO4和Na2SO410H2O的溶解度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→ →用乙醇洗涤→干燥.用乙醇洗涤而不用水洗的原因是 。
(5)用惰性电极电解MnSO4和ZnSO4制得Zn和MnO2的总反应是: 。
(6)本工艺可以循环利用的物质除MnO2、MnCO3、ZnCO3以外,还有 (写化学式)。
【答案】(1)60%;
(2)2H2SO4;S;2H2O;
(3)将溶液中的硫酸铜转化为铜;Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+;
(4)趁热过滤,防止Na2SO4固体因溶解而减少,防止Na2SO4固体转变为Na2SO410H2O晶体;
(5)MnSO4+ZnSO4+2H2O![]() Zn+MnO2+2H2SO4;
Zn+MnO2+2H2SO4;
(6)Zn
【解析】
试题分析:(1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣,则
MnO2~I2~2S2O32﹣
1 2
n 0.1000molL﹣1×0.050L
解得n=0.0025mol
1L溶液中含MnO2物质的量=0.0025mol×![]() =0.1mol
=0.1mol
则软锰矿中MnO2含量=![]() ×100%=60%;
×100%=60%;
(2)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4和MnSO4硫单质,反应的化学方程式为:MnO2+CuS+2H2SO4=S↓+CuSO4+MnSO4+2H2O;
(3)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会继续反应置换出铁;反应的离子方程式为:Zn+Fe2+=Fe+Zn2+或Zn+Mn2+=Mn+Zn2+;
(4)图像分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物;
(5)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出,电极反应为:Zn2++2e﹣=Zn;二氧化锰是在阳极锰离子失电子生成,电极反应为:Mn2+﹣2e﹣+2H2O=MnO2+4H+,反应的化学方程式为:MnSO4+ZnSO4+2H2O![]() Zn+MnO2+2H2SO4;
Zn+MnO2+2H2SO4;
(6)依据流程图可知能循环使用的物质为Zn、ZnCO3、MnCO3和MnO2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【原创题】下列有关化学实验事故的处理中不正确的是()
A.少量的浓硫酸溅到皮肤上时,应用大量的水冲洗并涂上3%~5%的NaHCO3溶液
B.在化学实验过程中,若眼睛被碱性物质灼伤,应该立即用大量流水冲洗,边洗边眨眼睛然后再用20%的硼酸溶液淋洗
C.在实验过程中,被烫伤后,应该用冷水冲洗
D.实验室发生火灾时,要根据火灾产生的不同原因,采用不同的灭火方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种含有结晶水的盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出两种阳离子和一种阴离子,其中A、B两元素可形成10电子的阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。
用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入过氧化氢的酸性溶液,呈红色;
③取少量甲溶液于试管中,向其中加入稀盐酸后,再加入BaCl2溶液,出现白色沉淀;
④取少量甲溶液于试管中加入适量NaOH溶液,加热;
回答下列问题:
(1)实验③可证明溶液中含有 。
(2)用离子方程式表示实验②中现象的原因: , 。
(3)实验④中出现的现象是 。
(4)经测定甲晶体的摩尔质量为392 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钠、氢氧化钠 B.氧化铜、二氧化锰
C.氯化钾、二氧化锰 D.硫酸铜、氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃(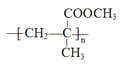 )因具有良好的性能而广泛应用于生产生活中。下图所示流程可用于合成有机玻璃,请回答下列问题:
)因具有良好的性能而广泛应用于生产生活中。下图所示流程可用于合成有机玻璃,请回答下列问题:
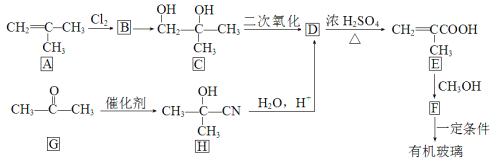
(1)A的名称为_______________;
(2)B→C的反应条件为_______________;D→E的反应类型为_______________;
(3)两个D分子间脱水生成六元环酯,该酯的结构简式为______________;
(4)写出下列化学方程式:
G→H:_______________________________;
F→有机玻璃:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3A+B═2C,下列说法正确的是()
A. 某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的
B. 其他条件不变,增大压强,反应速率加快
C. 若增加或减小B的物质的量,则反应速率一定会发生明显的变化
D. 其他条件不变,升高温度,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A.同压强、同体积的N2O和CO2 B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同质量、不同密度的N2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处
C.蒸发结晶时应将溶液完全蒸干
D.洗涤沉淀的方法是向漏斗中加水,使水没过沉淀,等水流完后再重复操作几次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为H2A===H++HA-,HA-![]() H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是( )
H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.在0.1 mol/L的H2A溶液中,c(H+)=0.12 mol/L
D.若0.1 mol/L NaHA溶液中c(H+)=0.02 mol/L,则0.1 mol/L的H2A中c(H+)<0.12 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com