
| A. | 还原剂是含CN-的物质,氧化产物不只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 参与反应的氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 标准状况下若生成2.24LN2则转移电子1mol |
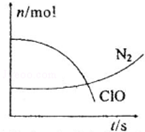
分析 由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价升降最小公倍数为2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-.
解答 解:由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价总共升降最小公倍数为2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-.
A、反应中,C元素化合价由CN-中+2价升高为HCO3-中+4价,N元素化合价由CN-中-3价升高为N2中0价,可知氧化产物有HCO3-、N2,故A正确;
B、反应中Cl元素化合价由ClO-中+1价降低为Cl-中-1价,ClO-是氧化剂,还原产物是Cl-,故B错误;
C、由上述分析可知,反应为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,反应中是CN-是还原剂,ClO-是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,故C正确;
D、2.24LN2(标准状况)的物质的量为0.1mol,所以参加反应的ClO-的物质的量为0.5mol,反应中只有氯元素化合价降低,由ClO-中+1价降低为Cl-中-1价,所以转移电子为0.5mol×2mol=1mol,故D正确.
故选B.
点评 本题考查氧化还原反应计算、基本概念等,题目难度中等,根据曲线变化图分析反应物、产物,利用守恒生成方程式是关键,侧重于考查学生的分析能力和计算能力.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
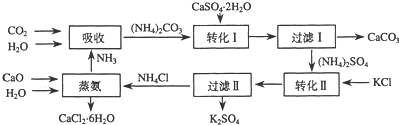
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0,△S>0所有温度下反应能自发进行 | |
| B. | 化合反应都是放热反应,分解反应都是吸热反应 | |
| C. | 凡是放热反应都是自发的,吸热反应都是非自发性的 | |
| D. | 自发反应一定不需要任何条件就容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amolA,同时生成3amolC | |
| B. | 容器的压强不再变化 | |
| C. | 混合气体的物质的量不再变化 | |
| D. | C的生成速率与B的生成速率的比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60乙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HO3-和CO32-E离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 同温、同压、同体积的CO和NO含有的质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
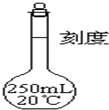 欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.
欲配制250mL0.1mol/L的NaOH溶液,回答下列有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中滴入石蕊试液后溶液呈蓝色,证明该溶液一定是碱的溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液产生白色沉淀,证明该溶液一定是盐酸 | |
| C. | 某白色固体与熟石灰混合研磨后产生有刺激性的氨味,证明该固体是铵盐 | |
| D. | 向某固体中加入稀盐酸产生气泡,证明该固体一定是碳酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com