
【题目】X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为_______、_________、___________
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有_________、________,将该化合物溶于水,得到常温下pH=a的溶液,此时水电离的c(H+)=________
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是______。此化合物在酸性条件下与高锰酸钾反应的离子方程式为______,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为:_______
(4)有一瓶固体药品的标签被损坏了,残留部分如图,已知该固体溶于水呈碱性,请推测该固体的化学式可能是(写3种)______
【答案】H O Na NaOH Na2O2(或NaO2) 10-a mol/L H2O2 5H2O2+2MnO![]() +6H+===2Mn2++8H2O+5O2↑ H2O2+CN-+OH-===CO
+6H+===2Mn2++8H2O+5O2↑ H2O2+CN-+OH-===CO![]() +NH3 NaH、NaHCO3、NaHS
+NH3 NaH、NaHCO3、NaHS
【解析】
X原子形成的单质是密度最小的气体,则X为H;Y原子最外层电子数是其周期数的三倍,Y原子只能有2个电子层,最外层电子数为6,可推知Y为O;Z与X原子最外层电子数相同,则Z是钠。
(1)由分析可知,X、Y和Z的元素符号分别为H、O、Na;
(2)由H、O、Na元素组成的化合物中,既含有共价键又含有离子键的有NaOH(离子键和极性共价键)、Na2O2(离子键和非极性共价键),将该化合物溶于水,得到常温下pH=a的NaOH溶液,水的电离受到抑制,此时水电离的c(H+)=10-a mol/L;
(3)H、O组成的化合物中,既含有极性共价键又含有非极性共价键的是H2O2,过氧化氢的电子式为![]() 。H2O2在酸性条件下与高锰酸钾反应的离子方程式为5H2O2+2MnO
。H2O2在酸性条件下与高锰酸钾反应的离子方程式为5H2O2+2MnO![]() +6H+===2Mn2++8H2O+5O2↑,H2O2将碱性工业废水中的CN-氧化为碳酸盐和氨的离子方程式为:H2O2+CN-+OH-===CO
+6H+===2Mn2++8H2O+5O2↑,H2O2将碱性工业废水中的CN-氧化为碳酸盐和氨的离子方程式为:H2O2+CN-+OH-===CO![]() +NH3;
+NH3;
(4)残留部分如图且已知该固体溶于水呈碱性,推测该固体很可能为NaH或强碱弱酸盐,并且酸式根电离程度小于水解程度,化学式可能是NaHCO3、NaHS等。


科目:高中化学 来源: 题型:
【题目】18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫 酸100 ml,实验操作如下:
(1)计算并用量筒量取 ml的18.0 mol·L-1的浓硫酸;
(2)将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、NH4+、Cl-、H+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.04mol。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验数据,填写下列空白。
(1)一定不存在的离子有_________。
(2)第②步操作发生反应的离子方程式为_________。
(3)第③步操作确定的离子有_________。
(4)无法确定是否存在的离子是_________,若满足n(K+)________0.02mol(填“>”、“<”或“=”)时,能确定其存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
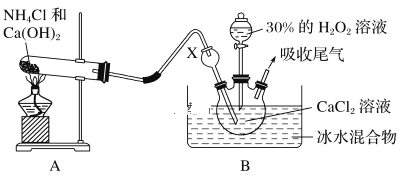
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.0.01molNH4+含有质子数为0.1NA
B.4.48 L N2与CO的混合物所含分子数为0.2NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2NA
D.10.0mL 12 mol·L-1浓盐酸与足量二氧化锰反应,转移电子数为0.06NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型的乙醇电池,它用磺酸类质子溶剂,在200 ℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意如图,下列说法不正确的是( )
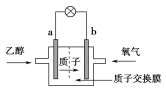
A. a极为电池的负极
B. 电池工作时,电流由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为4H++O2+4e-===2H2O
D. 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
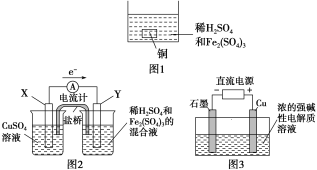
A. 如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO![]() )为0.5 mol/L
)为0.5 mol/L
B. 如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜
C. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D. 如图3所示当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是
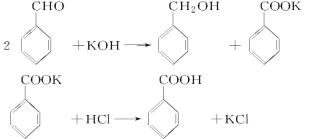
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
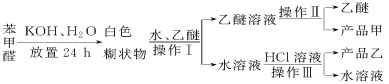
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
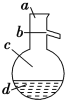
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是__________________,收集产品甲的适宜温度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol,则该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() =
=![]() ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com