
【题目】用双线桥法表示下列反应的电子转移情况并将其改写成离子方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,________________________,离子方程式为________________________。当3.84gCu被氧化时,__________gHNO3被还原,产生标准状况下的气体________L,转移电子数为________。
【答案】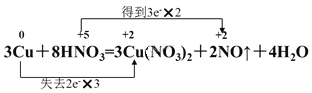 3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O 2.52g 0.896L 0.12NA或7.224×1022
3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O 2.52g 0.896L 0.12NA或7.224×1022
【解析】
化合价升高元素Cu失电子,化合价降低元素N得到电子,化合价升高数=化合价降低数=转移电子数=6,电子转移情况如下: ;
;
反应的离子方程式为3Cu+8H++2NO3═3Cu2++2NO↑+4H2O,
依据氧化还原反应电子守恒规律:3.84g÷64 g/mol×2=n(HNO3)×3,解得被还原硝酸的物质的量是0.04mol,被还原硝酸的质量是m=n×M=0.04mol×63g/mol=2.52g; V(NO)=0.04mol×22.4L/mol=8.96L;
转移电子数=失电子数=得电子数=3.84g÷64 g/mol×2×NA=0.12NA。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。
Ⅰ.实验室制备NaN3
(1)实验原理:
①把氨气通入熔融金属钠反应制得氨基钠(NaNH2),该反应的化学方程式为____________。
②将生成的NaNH2与N2O在210℃-220℃下反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______。
(2)实验装置(图1)、步骤如下,回答下列问题:
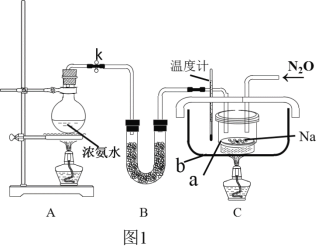
已知:i)NaN3是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
ii)NaNH2的熔点为210℃,沸点为400℃,在水溶液中易水解。
①组装仪器检查装置气密性后,装入药品。装置B中盛放的药品是_______________。
②实验过程应先点燃___(填“A”或“C”)处的酒精灯,理由是_______________________。
③让氨气和熔化的钠充分反应后,停止加热A并关闭止水夹k。向装置C中b容器内充入加热介质植物油并加热到210℃-220℃,然后按图通入N2O;
④装置C反应完全结束后,冷却,取出a中的混合物进行以下操作,得到NaN3固体:

操作II的目的是____________;
操作IV中选用的洗涤试剂最好的是_____。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
(3)图中仪器a用不锈钢材质的而不用玻璃的,其主要原因是____________________。
II.产品NaN3纯度测定
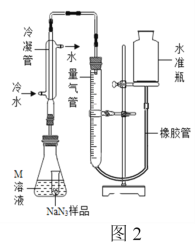
精确称量0.150 g NaN3样品,设计如图2所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度。
已知2 NaN3→ 3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)使用冷水冷凝的目的是______。对量气管读数时,反应前后都需要进行的操作是______。
(5)常温下测得量气管读数为60.0 mL(N2的密度为1.40 g/L)计算NaN3样品的纯度为______。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间1的变化如图1所示,已知反应达到平衡后,降低温度,A的转化率将增大。

(1)根据图1数据。写出该反应的化学方程式:_____________;此反应的平衡常数表达式为K=_________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是_________。
(3)图2表示此反应的反应速率v和时间t的关系,t3、t5、t6时刻各改变一个且互不相同的条件,各阶段的平衡常数如下表所示。K1、K2、K3、K4之间的关系为________(用“>”“<”或“=”连接)。A的转化率最大的一段时间是___________。
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K1 | K2 | K3 | K4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超导材料为具有零电阻及磁性的物质,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导物,依化学计量数比例需取Y2O3、BaCO3和CuO的物质的量分别为( )
A. 0.50 mol、0.50 mol、0.50 mol B. 0.25 mol、1.0 mol、1.5 mol
C. 0.50 mol、1.0 mol、1.5 mol D. 1.0 mol、0.25 mol、0.17 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
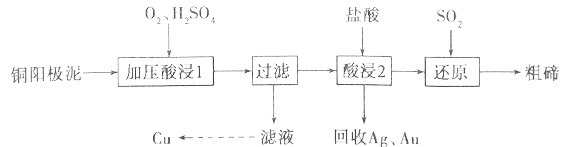
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是__________________________,其中“加压”的目的是______________________。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式_________________________________。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为______________________。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是______________________。
(3)写出“还原”反应中发生的离子方程式_________________________________。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为_________________________________。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=___________(已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代社会环境变化快、生活节奏快,很多人心理压力过大,紧张焦虑,导致抑郁患者量增加。某研究小组按下列路线合成抗抑郁药物吗氯贝胺:
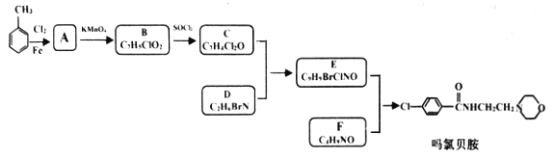
已知: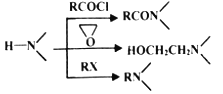
请回答:
(1)下列说法正确的是___________。
A.化合物A分子中有两种氢原子 B.合成路线所涉反应均为取代反应
C.化合物D具有碱性 D.吗氯贝胺能发生水解反应
(2)化合物F的结构简式是______________________。
(3)写出C+D→E的化学方程式____________________________________________。
(4)为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请设计以环氧乙烷(![]() )为原料合成X的合成路线_________________________________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线_________________________________(用流程图表示,无机试剂任选)。
(5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同分异构体的结构简式为______________________(任写一种)。
①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)![]() cC(g) H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是
cC(g) H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是
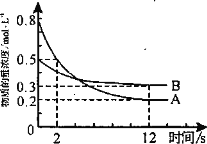
A. 2s时,A的反应速率为0.15mol·L-1·s-1
B. 图中交点时A的消耗速率等于A的生成速率
C. 化学计量数之比b ∶c = 1∶2
D. 12s内反应放出0.2QkJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:
(1)写出A与D以1∶1的原子个数比形成的化合物的电子式:______________。F的离子结构示意图为_______________________。
(2)B、D形成的化合物BD2中存在的化学键为________键(填“离子”或“共价”,下同)。A、D、E三种元素形成的化合物为____________化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为________________________________。
(4)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。1 mol C2A4液体和足量C2D4液体完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y(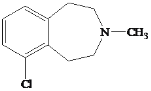 )是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
)是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
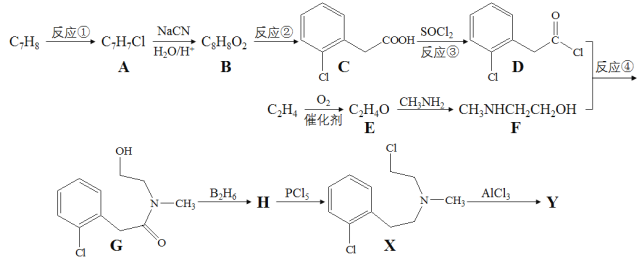
已知:RX+NaCN![]() RCN
RCN![]() RCOOH
RCOOH
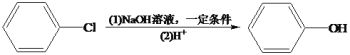
请回答:
(1)写出化合物H的结构简式_______________。
(2)下列说法不正确的是______________。
A.反应①的试剂与条件为Cl2/光照
B.化合物E能发生银镜反应
C.化合物G→Y的转化过程中,涉及的反应类型有取代反应、加成反应
D.Y的分子式为C11H13NCl
(3)写出反应④的化学方程式________________。
(4)芳香族化合物M是B的同分异构体,M含有二个六元环,则M可能的结构有_______________。
(5)已知一个碳原子上连有两个羟基是不稳定的,会脱水转化为羰基。试写出由C的一种同分异构体制备合成 的线路图。___________
的线路图。___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com