
【题目】明矾[KA1(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如下图所示。
下列叙述错误的是
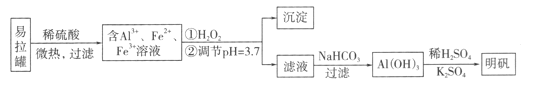
A. 合理处理易拉罐有利于环境保护和资源再利用
B. 从易拉罐中可回收的金属元素有Al、Fe
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示。则:
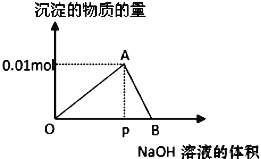
(1)写出OA段发生反应的离子方程式:OA段___,图中线段OP:PB=__,
(2)计算原AlCl3溶液的物质的量浓度为__mol/L,
(3)图中A对应的横坐标为__mL,
(4)当加入5mLNaOH溶液时,产生沉淀量为__mol,
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由N2、NO、CO2组成的混合气体中,三种成分的体积分数之比为1:2:1,则三种成分的质量比为________。
(2)等质量的钠和镁分别与足量的稀硫酸反应,放出气体的体积(同温同压)之比为________。
(3)同温同压下,某容器充满CO2重122 g,充满NO气体重115 g,现充满某气体B重123 g,则该气体的相对分子质量为_____。
(4)有15 g A物质和10.5 g B物质恰好完全反应生成7.2 g C物质、1.8 g D物质和0.3 mol E物质,则E物质的摩尔质量是_____g·mol-1。
(5)标准状况下,10 mL N2气体恰好与30 mL H2完全反应生成20 mL气体A,则A的分子式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.将铜片插入稀硝酸中:![]()
B.稀硫酸与Ba(OH)2溶液反应:![]()
C.向A12(SO4)3溶液中加入过量氨水:![]()
D.向Na2SiO3溶液中滴加醋酸:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇一空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图甲所示,该电池中正极的电极反应式为_____。
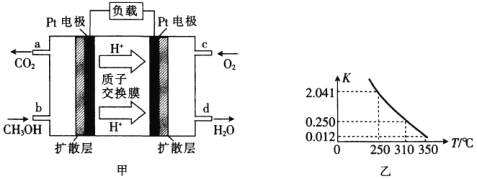
(2)工业上合成甲醇一般采用下列反应:![]() ,
,![]() ,图乙是该反应在不同温度下的化学平衡常数(K):
,图乙是该反应在不同温度下的化学平衡常数(K):
①由图中数据判断a_______0(填“>”“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为________℃。
(3)T℃时,在恒容密闭容器中发生反应:![]() ,各物质的浓度变化如图丙所示:
,各物质的浓度变化如图丙所示:
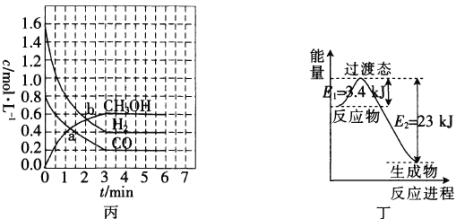
①反应从0min到3min之间,CH3OH的反应速率为________________。
②CO在0~1min和1~3min时平均反应速率[平均反应速率分别以v(0~1),v(1~3)表示]的大小为_____________________________。
(4)目前工业上有一种方法是用CO2和H2在230℃、催化剂条件下转化生成甲醇蒸气和水蒸气。图丁表示恒压容器中0.5molCO2和1.5molH2反应时转化率达80%的能量变化示意图。写出该反应的热化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,随着反应的进行,各物质的物质的量浓度变化如图所示。下列说法不正确的是
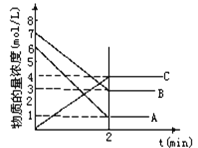
A.该反应的化学方程式为:5A+4B![]() 4C
4C
B.该反应达到平衡时,A、B、C的浓度比为5∶4∶4
C.用B的浓度变化表示2min内的速率为2 mol·L-1·min-1
D.2 min前,正反应速率逐渐减小,逆反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
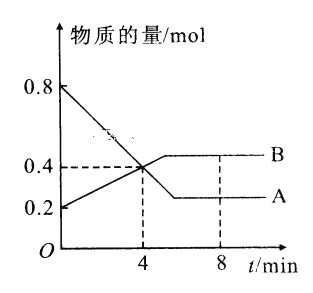
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
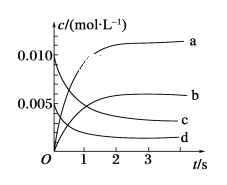
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)![]() G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
温度℃ | 25 | 80 | 230 |
平衡常数值 | 5×104 | 2 | 1.9× 10﹣5 |
A.上述反应是熵增反应
B.25℃时,反应G(g)![]() E(s)+4F(g)的平衡常数值是0.5
E(s)+4F(g)的平衡常数值是0.5
C.在80℃时,测得某时刻,F、G浓度均为0.5 mol·L﹣1,则此时v(正)>v(逆)
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面为甲、乙、丙三位同学制取乙酸乙酯的实验过程。
(实验目的)制取乙酸乙酯。
(实验原理)甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
1.(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
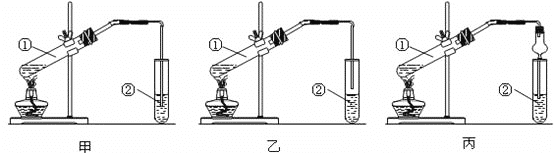
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,不应选择的装置是____(填“甲”或“乙”)。丙同学装置中的球形干燥管,除起冷凝作用外,另一重要作用是______。
2.(实验步骤)
(1)按选择的装置组装仪器,在试管中先加入amLCH3CH218OH(密度为ρg/cm-3)和过量的冰醋酸(CH3COOH),并边振荡边缓缓加入2mL浓H2SO4;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时认为反应基本完成。
(问题讨论)
a.按步骤(1)装好实验装置,加入药品前还应______。
b.在(5)中,当观察到试管②中有______现象时认为反应基本完成。
c.分离试管②中的混合物可以得到产品及回收未反应的乙酸和乙醇,实验操作流程如下:
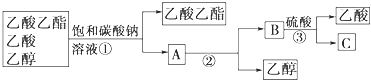
在上述实验操作流程中,所涉及的①②③三次分离操作分别是:______。
d.已知在酸与醇的酯化反应中,反应的原理是酸失去羟基,醇失去氢原子结合成水。请写出试管①中生成乙酸乙酯反应的化学方程式(注明反应条件)_____________。
最后得到纯净的乙酸乙酯bg,求本实验中乙酸乙酯的产率:______(用a、b、ρ表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com