
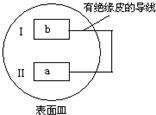
 把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )| A. | a是原电池的负极 | B. | b的活泼性大于a | ||
| C. | 无电流产生 | D. | b 电极上有气泡产生 |
分析 该装置为原电池中的吸氧腐蚀,一段时间后观察到区域I变红色,说明I作正极,氧气得到电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,破坏了水的电离平衡,使得OH-浓度增大,所以Ⅰ处变红,Ⅱ是活泼金属a作负极,失去电子发生氧化反应,据此解答.
解答 解:该装置为原电池中的吸氧腐蚀,一段时间后观察到区域I变红色,说明I作正极,氧气得到电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,破坏了水的电离平衡,使得OH-浓度增大,所以Ⅰ处变红,Ⅱ是活泼金属a作负极,失去电子发生氧化反应.
A.Ⅱ是活泼金属a作负极,失去电子发生氧化反应,故A正确;
B.a的活泼性大于b,故B错误;
C.原电池工作时有电流产生,故C错误;
D.b电极作正极,是氧气得电子发生还原反应,无气泡产生,故D错误;
故选A.
点评 本题考查了原电池的工作原理的应用,侧重考查学生分析和解决问题的能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷能燃烧,乙烯不能 | |
| B. | 甲烷和乙烯都能使溴水褪色 | |
| C. | 甲烷和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷和乙烯完全燃烧的产物都是CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着电子层数增多,碱金属的原子半径逐渐增大 | |
| B. | 碱金属具有强还原性,它们的离子具有强氧化性 | |
| C. | 碱金属单质的熔沸点随着核电荷数的增大而降低 | |
| D. | 碱金属元素在自然界中都是以化合态存在的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L | B. | 1.8 mol/L | C. | 1.9 mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 现象及结论 | |
| Ⅰ | 打开活塞a,滴加氯水,关闭活塞 | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 电池放电后,溶液PH不断升高 | |
| C. | 负极上O2得到电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 负极上CH4失去电子,电极反应式:CH4+10OH--8e-═CO32-+7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li原子的最外层电子数比Mg原子的最外层电子数少 | |
| B. | Mg原子的电子层数比Li原子电子层数多 | |
| C. | 1 mol Mg从酸中置换出的H2比1 mol Li从酸中置换出的H2多 | |
| D. | 氢氧化锂的碱性比氢氧化镁强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com