
分析 (1)根据铁、氧化铁都能与盐酸反应以及反应后溶液中无Fe3+,所以铁也与硫酸铁反应,先根据H2求出和硫酸生成1.68LH2的铁,然后根据混合物发生的反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe2(SO4)3+Fe=3FeSO4,可知n(Fe2O3):n(Fe)=1:1,求出Fe2O3和Fe的质量,最终求出混合物中Fe和Fe2O3的质量;
(2)由题意我们应该可以理解反应后溶液中只有Fe 2+而无Fe3+,而且硫酸有剩余,也就说固体与酸反应后溶液中得到的是FeSO4和硫酸的混合液,接着在这混合溶液中滴加NaOH溶液,先中和了硫酸,又与 FeSO4反应生成了Fe(OH)2沉淀,最终溶液中剩余物质其实就是Na2SO4.这样我们用守恒法考虑,SO4 2-来自原H2SO4,而Na+来自NaOH,这样得到H2SO4~2NaOH,最后根据c=$\frac{n}{V}$求出原硫酸的物质的量浓度.
解答 解:(1)因铁、氧化铁都能与硫酸反应:Fe+H2SO4=FeSO4+H2↑ Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,又因反应后溶液中无Fe3+,所以有反应为:Fe+Fe2(SO4)3=3FeSO4,
1.68L氢气的物质的量为:$\frac{1.68L}{22.4L/mol}$=0.075mol,根据反应Fe+H2SO4=FeSO4+H2↑可知与硫酸生成1.68LH2消耗的铁为0.075mol,其质量为:56g/mol×0.075mol=4.2g,剩余混合物质量为:15-4.2=10.8g,剩余的混合物发生如下反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4可得关系式Fe2O3~Fe2(SO4)3~Fe,所以剩余混合物中Fe2O3和Fe的物质的量应该为1:1,设二者物质的量都为n,则160n+56n=10.8g,解得:n=0.05mol,则m(Fe2O3)=160g/mol×0.05mol=8g,m(Fe)=56g/mol×0.05mol=4.2,原混合物中铁的质量为:4.2g+2.8=7g,
答:原混合物中含有7gFe,4.2gFe2O3;
(2)因为反应后溶液中无Fe3+存在,且固体没有剩余,则全都是以Fe2+的形式存在,反应后溶质为硫酸亚铁,根据质量守恒定律可知:n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=3mol/L×0.2L×$\frac{1}{2}$=0.3mol,
所以原稀H2SO4的物质的量浓度为:$\frac{0.3mol}{0.15L}$=2mol/L,
答:原稀H2SO4的物质的量浓度为2mol/L.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
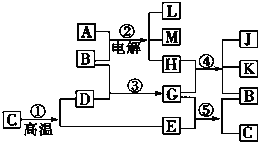 根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.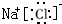
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L H2O中所含的原子总数为0.3NA | |
| B. | 0.1 molCl2与足量的NaOH稀溶液反应,转移的电子总数为0.2NA | |
| C. | 1mol•L一1的NaCl溶液中所含Na+数目为NA | |
| D. | 常温常压下,14g由N2和CO组成的混合气体中含有的原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
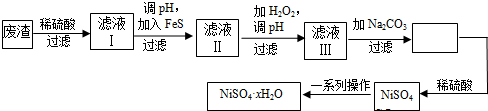
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 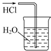 |  | 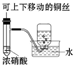 |
| A.制备少量氨气 | B.吸收HCl | C.配制一定浓度硫酸溶液 | D.制备并收集少量NO2气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2 Fe2+ | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 氯化钠(硝酸钾) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ②③ | B. | ①③ | C. | 只有③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | 实验结论 | 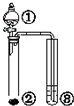 | |
| A. | 硫酸 | Na2SO3 | KMnO4 | SO2有漂白性 | |
| B. | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
| C. | H2O | 工业电石 | KMnO4 | 乙炔具有还原性 | |
| D. | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲=乙=丙=丁 | B. | 乙=丙>甲=丁 | C. | 乙>丙>甲>丁 | D. | 乙=丙>甲>丁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com