
| A. | 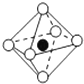 | B. | 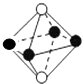 | C. | 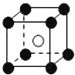 | D. |  |
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 四氯化碳的比例模型  | |
| C. | 氧原子的电子排布图  | |
| D. | ${\;}_{8}^{16}$O2-离子的结构示意图: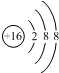 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓氢溴酸反应CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热CH3CH2Br+NaOH$→_{△}^{水}$ CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入少量的二氧化碳2 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 乙醛催化氧化 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
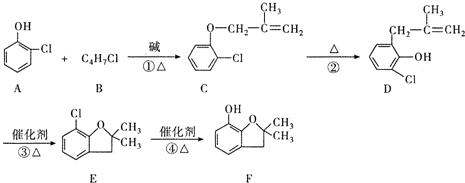
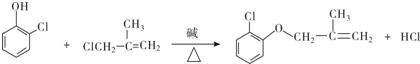 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).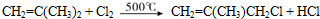
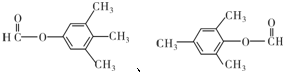
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④⑤ | C. | ②④⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
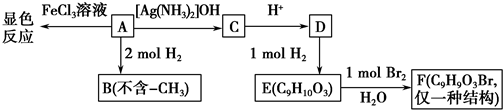
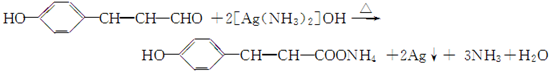 .
. .
. ,G的结构简式为:
,G的结构简式为: .
. .
. 或
或 (写出一个反应方程式即可).
(写出一个反应方程式即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
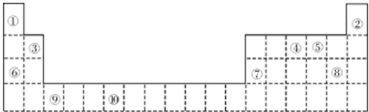
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com