
| A. | 金刚石与石墨互为同位素 | |
| B. | 相同物质的量的石墨具有的能量比金刚石具有的能量高 | |
| C. | 金刚石不如石墨稳定 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
分析 12g石墨完全转化成金刚石时需要吸收E kJ的能量,说明石墨的能量低于金刚石的能量,石墨更稳定,金刚石的能量高,等质量石墨和金刚石完全燃烧时释放的能量金刚石比石墨多.
解答 解:A、金刚石与石墨是由碳元素组成的物理性质不同的单质,互为同素异形体,故A错误;
B、石墨转化为金刚石要吸收能量,说明石墨的能量低于金刚石,故B错误;
C、石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨比金刚石稳定,故C正确;
D、金刚石的能量高,等质量的石墨和金刚石完全燃烧时释放的能量金刚石比石墨多,石墨放出的能量少,故D错误.
故选C.
点评 本题考查金刚石和石墨的转化以及涉及到的能量变化,注意能量低的物质更稳定即可解答.


科目:高中化学 来源: 题型:解答题
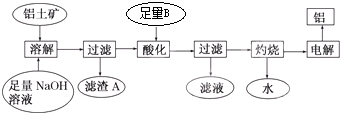
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题



| A. | 2mol、2mol、6 mol | B. | 5mol、2mol、6 mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com