
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂。它易溶于水,不溶于醇,受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
(1)b中反应的离子方程式为________________,c中试剂为________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是________。
(3)d中的试剂为________。
(4)实验中要控制SO2生成速率,可以采取的措施有___________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是______________________。
(6) 所得产品常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
①取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
②为减少装置C中生成Na2SO4的量,在实验过程中应注意的操作顺序是_____________________________________________________________________________。

【知识点】化学实验操作 B2 D3 G1
【答案解析】(16分)SO +2H+===SO2↑+H2O或HSO
+2H+===SO2↑+H2O或HSO +H+===SO2↑+H2O (2分)硫化钠和碳酸钠混合溶液(2分)
+H+===SO2↑+H2O (2分)硫化钠和碳酸钠混合溶液(2分)
(2)硫(2分) (3)NaOH溶液(2分)
(4)控制反应温度、调节酸的滴加速率(或调节酸的浓度等) (2分)
(5)若SO2过量,溶液显酸性,产物分解(2分)
(6)①过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸 (2分)
②先向烧瓶滴加浓H2SO4,产生的气体将装置中的空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液(2分)
解析::(1)第一个装置为二氧化硫的制取装置,制取二氧化硫的原料为亚硫酸钠和70%的浓硫酸,反应的离子方程式为:SO +2H+===SO2↑+H2O,c装置为Na2S2O3的生成装置,根据反应原理可知c中的试剂为:硫化钠和碳酸钠的混合溶液,故答案为:SO
+2H+===SO2↑+H2O,c装置为Na2S2O3的生成装置,根据反应原理可知c中的试剂为:硫化钠和碳酸钠的混合溶液,故答案为:SO +2H+===SO2↑+H2O或HSO
+2H+===SO2↑+H2O或HSO +H+===SO2↑+H2O 硫化钠和碳酸钠混合溶液
+H+===SO2↑+H2O 硫化钠和碳酸钠混合溶液
(2)反应开始时发生的反应为:Na2S+4SO2+H2O=2H2S+Na2SO3,SO2+2H2S=3S↓+2H2O,故该浑浊物是S,故答案为:S;
(3)d装置为尾气吸收装置,吸收二氧化硫和硫化氢等酸性气体,应选用氢氧化钠溶液,故答案为:氢氧化钠溶液;
(4)通过控制反应的温度或硫酸的滴加速度可以控制SO2生成速率,故答案为:控制反应的温度或硫酸的滴加速度;
(5)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解
(6)①根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,故答案为:过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸;
②因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;
【思路点拨】本题考查了物质制备实验方案的设计和制备过程分析应用,掌握基础如离子反应方程式、定性检验、除杂,注意积累是解题关键,题目难度中等.


科目:高中化学 来源: 题型:
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)(mol·L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 50 | 粉末状 |

A.4-3-2-1 B.1-2-3-4
C.3-4-2-1 D.1-2-4-3
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列变化中,①I2的升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水,未发生化学键破坏的是________;仅发生离子键破坏的是________;仅发生共价键破坏的是________;既发生共价键破坏又发生离子键破坏的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、X均为中学化学常见的物质,它们之间有如下转化关系(其它产物已略去):
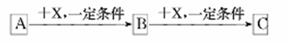
下列说法不正确的是
A.若A是NH3则C可能是氧化物
B.若A是非金属单质,则C与水反应的生成物为强酸
C若X是金属单质,则B、C 中X的化合价可能是B>C
D.若X是强碱,则B可能是两性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A.Cl2通入FeSO4溶液中 B.CO2通入Ca(OH)2溶液中
C.将AlCl3溶液滴入 NaOH 溶液中 D.SO2通入BaCl2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是
A、氢气通过灼热的CuO粉末 B、二氧化碳通过Na2O2粉末
C、铝与Fe2O3发生铝热反应 D、将锌粒投入FeCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
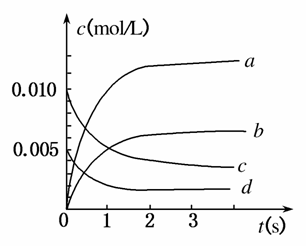
(1)写出该反应的平衡常数表达式:K=____________。已知:K300℃>K350℃,则该反应是____________热反应。
(2)图中表示NO2变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是__________。
a. v(NO2)=2v(O2)
b.容器内压强保持不变
c. v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com