
分析 (1)令质量分数为p%的硫酸的密度为dg/mL,3p%的硫酸的密度为Dg/mL,溶液体积为VmL,根据硫酸溶液的浓度愈大,其密度就愈大,则d<D,根据m=ρV表示出两硫酸溶液的质量,进而表示出混合后溶液总质量、溶质硫酸总的质量,再根据ω=$\frac{m(溶质)}{m(溶液)}$表示出混合后硫酸的质量分数,结合密度关系进行判断;
(2)若溶质是乙醇而非硫酸,乙醇溶液的浓度越大,其密度越小,则d>D,结合(1)中表达式判断.
解答 解:(1)令质量分数为p%的硫酸的密度为dg/mL,3p%的硫酸的密度为Dg/mL,溶液体积为VmL,
则混合后溶液的质量为:dg/mL×VmL+Dg/mL×VmL=V(d+D)g,
混合后溶质硫酸的总质量为:dg/mL×VmL×p%+Dg/mL×VmL×3p%=V(p%d+3p%D)g,
混合后硫酸的质量分数为:q%=$\frac{V(p%d+3p%D)g}{V(d+D)g}$=p%+$\frac{2p%D}{d+D}$=p%+2p%×$\frac{1}{1+\frac{d}{D}}$,
硫酸溶液的浓度愈大,其密度就愈大,则d<D,故1+$\frac{d}{D}$<2,则2p%×$\frac{1}{1+\frac{d}{D}}$>p%,故q%>2p%,即q>2p,
故答案为:②;
(2)若溶质是乙醇而非硫酸,乙醇溶液的浓度越大,其密度就越小,则d>D,则1+$\frac{d}{D}$>2,则2p%×$\frac{1}{1+\frac{d}{D}}$<p%,故q%<2p%,即q<2p,
故答案为:③.
点评 本题考主要考查了溶质质量分数的计算,难度中等,关键是清楚硫酸溶液、乙醇溶液浓度与质量分数关系,侧重考查对学生的数据处理能力,注意形成规律:1、两种溶质质量分数不同的同种溶液等质量混合时,混合后溶液的质量分数为稀浓溶液质量分数的平均值;2、对于溶液的密度大于1g/mL,溶质质量分数越大密度越大,浓、稀两种溶液等体积相混后,溶质质量分数大于平均值;3、对于溶液的密度小于1g/mL,溶质质量分数越大密度越小,浓、稀两种溶液等体积相混后,溶质质量分数小于平均值.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 测定中和热实验的玻璃仪器只需烧杯、量筒和温度计 | |
| B. | 用25mL碱式滴定管量取13.50mL Na2CO3溶液 | |
| C. | 用10mL量筒量取5.5mL硫酸溶液 | |
| D. | 用广泛pH试纸不能测得某碱溶液的pH为12.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯都可通过加聚反应合成塑料 | |
| B. | 油脂、糖和蛋白质都能发生水解反应 | |
| C. | 只用Cu(OH)2:悬浊液就可鉴别乙醇、乙醛和乙酸 | |
| D. | 苯分子中所有的原子都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若在与硝酸反应后的溶液中再加入Fe,金属可能溶解 | |
| B. | 消耗的氢氧化钠的体积为100mL | |
| C. | b=a+5.1 | |
| D. | a的范围为:3.6<a<5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
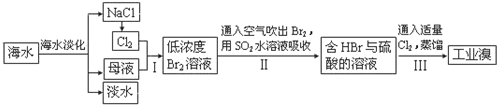
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
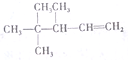 命名3,4,4-三甲基-1-戊烯
命名3,4,4-三甲基-1-戊烯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.0020mol/(L•s) | B. | v(O2)=0.0026mol/(L•s) | ||
| C. | v(NO)=0.0020mol/(L•s) | D. | v(H2O)=0.0028mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述电解过程中铜转移2mol电子 | B. | 电解后溶液中c(H+)为4mol/L | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 原混合溶液中c(K+)为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H +)=$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和Na2CO3溶液中,水的电离程度相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com