
【题目】已知:25℃时,CH3COOH和NH3H2O的电离常数相等.
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3. ①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为 , 溶液中 ![]() (填“增大”“减小”“不变”或“不能确定”).
(填“增大”“减小”“不变”或“不能确定”).
②25℃时,0.1mol/L氨水(NH3H2O溶液)的pH= . 用pH试纸测定该氨水pH的操作方法为 .
③氨水(NH3H2O溶液)电离平衡常数表达式Kb= , 25℃时,氨水电离平衡常数约为 .
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中 ![]() (填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(填序号). a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
当加入CH3COOH溶液体积为10mL时,混合溶液的pH7(填“>”“=”“<”).
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图.已知:pOH=﹣lgc(OH﹣). 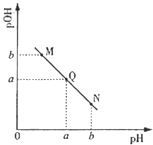
①图中M,Q,N三点所示溶液中水的电离程度最大的是(填字母).
②若Q点时滴加醋酸溶液体积为V2 mL,则V1V2(填“>”“=”“<”).
③若在曲线上某一点W时加入醋酸的体积为V1 mL,则W点应位于图中曲线上Q点的(填“上方”“下方”),此时溶液中离子浓度由大到小的顺序为 .
【答案】
(1)3<PH<5;不变;11;将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;![]() ;1.0×10﹣5
;1.0×10﹣5
(2)b;=
(3)Q;<;下方;c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
【解析】解:(1)①25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3,溶液加水稀释至1000mL,氢离子浓度减小,PH大于3,醋酸电离被促进又电离出氢离子,氢离子浓度减小小于1000倍,则溶液PH小于5,溶液PH取值范围为:3<PH<5,溶液中离子浓度之比= ![]() =
= ![]() ×
× ![]() =
= ![]() ,电离平衡常数和离子积常数随温度变化,所以加水稀释
,电离平衡常数和离子积常数随温度变化,所以加水稀释 ![]() 比值不变,所以答案是:3<PH<5,不变;
比值不变,所以答案是:3<PH<5,不变;
②25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10﹣3mol/L,溶液PH=11,pH试纸测定pH的方法是:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值,
所以答案是:11,将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;
③氨水(NH3H2O溶液)溶液中电离平衡为:NH3H2ONH4++OH﹣ , 电离平衡常数表达式Kb= ![]() ,25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10﹣3mol/L,Kb=
,25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10﹣3mol/L,Kb= ![]() =
= ![]() =1.0×10﹣5 ,
=1.0×10﹣5 ,
所以答案是: ![]() ,1.0×10﹣5;(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液发生反应生成醋酸铵溶液,铵根离子浓度增大,一水合氨浓度减小,
,1.0×10﹣5;(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液发生反应生成醋酸铵溶液,铵根离子浓度增大,一水合氨浓度减小, ![]() 比值减小,当加入CH3COOH溶液体积为10mL时,酸碱恰好完全反应生成醋酸铵溶液,25℃时,CH3COOH和NH3H2O的电离常数相等,醋酸根离子和铵根离子水解程度相同,溶液显中性,
比值减小,当加入CH3COOH溶液体积为10mL时,酸碱恰好完全反应生成醋酸铵溶液,25℃时,CH3COOH和NH3H2O的电离常数相等,醋酸根离子和铵根离子水解程度相同,溶液显中性,
所以答案是:b,=;(3)①图像分析可知N点PH>POH,溶液显碱性,M点POH>PH,溶液显酸性,酸碱抑制水的电离,Q点POH=PH,溶液显中性,水的电离程度最大,
所以答案是:Q;
②若Q点时滴加醋酸溶液体积为V2 mL,若恰好反应生成醋酸钠溶液显碱性,所以溶液呈中性醋酸应过量,V1<V2 , 所以答案是:<;
③若在曲线上某一点W时加入醋酸的体积为V1 mL,是醋酸和氢氧化钠溶液恰好反应生成醋酸钠,醋酸根离子水解溶液显碱性,PH>POH,所以溶液W点应位于图中曲线上Q点的下方,此时溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),
所以答案是:下方,c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+);
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
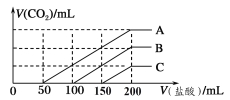
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些含氯产品。

(1)储氯钢瓶中应贴的标签为_________(填字母代号)。
A.易燃品 B.有毒品 C.爆炸品
(2)“威猛先生”使用注意事项中特别说明在使用时切勿与漂白剂一同使用,否则会产生有害气体。“84”消毒液的有效成分是次氯酸钠,写出“84”消毒液与“威猛先生”(有效成分为盐酸)混合后反应的离子方程式_______。
(3)漂白粉的有效成分是_______(填化学式),老师新买的漂白粉没有保存说明书,请你为漂白粉设计一份保存注意事项,并用化学用语解释设计原因。
注意事项(不超过30个字):_________________。
解释(用化学用语):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要除去KNO3溶液中混有的少量Ba(NO3)2杂质,得到纯净的KNO3溶液,操作正确的是( )
A. 加入适量的Na2CO3溶液,过滤
B. 加入足量的K2CO3溶液,过滤
C. 先加入过量的K2CO3溶液,过滤,再向滤液中加入适量的稀盐酸
D. 先加入过量的K2CO3溶液,过滤,再向滤液中加入适量的稀HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验基本操作的叙述不正确的是( )
A. 使用分液漏斗和容量瓶时,首先要查仪器是否漏液
B. 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生暴沸
C. 用蒸发皿进行加热蒸发时,不需垫石棉网可直接进行
D. 将浓硫酸倒入盛水的量筒中稀释成稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜(Cu-Zn)是我国最早大量使用的合金,其中锌是现代工业上常用金属。
I. 某废催化剂含58.2%的SiO2(不溶于水和稀酸)、21.0%的ZnO、4.5%的ZnS(不溶于水但溶于稀酸)和12.8%的CuS(不溶于水也不溶于稀酸)。某同学用15.0 g该废催化剂为原料,以稀硫酸和H2O2为试剂,回收其中的锌和铜。
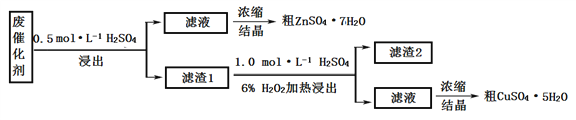
(1)浸出后的操作中,使用到的玻璃仪器有:烧杯、玻璃棒、__________________。
(2)滤渣2是______,第二次浸出发生的反应化学方程式是_________________________。
(3)两次结晶的操作是_________________________________________________________。
(4)某同学在实验完成之后,得到1.5gCuSO4·5H2O(M=250 g·mol–1),则铜的回收率为_______。
II.锌的化学性质与铝相似,锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(5)Al溶于NaOH溶液,反应的离子方程式为:_______________________________。
(6)Zn溶于NaOH溶液,反应的化学方程式为:_______________________________。
(7)下列各组中的两种溶液,用相互滴加的实验方法不可鉴别的是____________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面三个图是某研究小组利用过氧化氢酶探究H2O2分解条件而获得的实验结果.请回答下列有关问题:

(1)图1、2、3所代表的实验中,实验自变量依次为 , , .
(2)根据图1可以得出的实验结论是 _.
(3)图2曲线bc段产生的最可能原因是 .
(4)若进行图2所代表的实验时增加过氧化氢酶的含量,请在图2中,利用虚线绘出曲线的变化
(5)能否以H2O2为材料来探究温度对H2O2酶活性的影响? 为什么 .
(6)酶的作用原理 ,酶的本质 . .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | — | 338.0 | 1.84 |
实验室制取乙酸乙酯的主要步骤如下:①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min;③待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,然后静置分层;

图1
④分离出乙酸乙酯层、洗涤和干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:________________________________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要用小火均匀加热,其主要原因是________________________________________________________________________。
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),
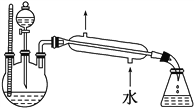
图2
与图1所示装置相比,此装置的主要优点有________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com