
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
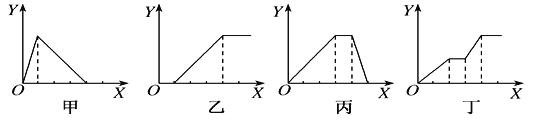
A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
【答案】C
【解析】
A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡,先产生氢氧化铝沉淀:AlCl3+3NaOH=Al(OH)3↓+3NaCl,继续滴加NaOH溶液,Al(OH)3和NaOH溶液反应,生成偏铝酸钠,沉淀溶解:NaOH+ Al(OH)3=NaAlO2+2H2O,所以沉淀量达到最大消耗NaOH和沉淀溶解消耗NaOH的比为3:1;A错误;
B.向NaAlO2溶液中滴加稀盐酸,立刻产生白色氢氧化铝沉淀,发生反应:AlO2-+H++H2O= Al(OH)3↓,随着盐酸的逐滴加入,开始形成的沉淀又逐渐溶解,发生反应:Al(OH)3+3H+=Al3++3H2O,所以沉淀量达到最大消耗的盐酸和沉淀完全溶解消耗的盐酸的物质的量之比是1:3.B错误;
C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液,开始滴加NaOH发生反应为Al3++3OH-= Al(OH)3↓,先产生氢氧化铝沉淀,当Al3+沉淀完全后,然后发生反应NH4++OH-=NH3H2O;此时沉淀氢氧化铝的量不变,最后继续滴加NaOH,发生反应Al(OH)3+OH-=AlO2-+2H2O,氢氧化铝沉淀溶解,沉淀量达到最大消耗NaOH、沉淀量不变和沉淀溶解消耗NaOH的比为3:1:1;C正确;
D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量,首先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,产生白色沉淀,然后发生:CO2+2NaOH=Na2CO3+H2O,此时沉淀的量不变,再发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,产生沉淀,又发生反应:CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2=Ba(HCO3)2, CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2=Ba(HCO3)2,Na2CO3+H2O+CO2=2NaHCO3沉淀量不变,最后发生反应:BaCO3+2H2O+2CO2=Ba(HCO3)2,沉淀部分溶解,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】I.利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意?____ (填“是”或“否”)。
(2)乙同学依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示:
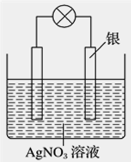
①负极材料是_______,发生的电极反应为____________________________。
②当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4 g,则该原电池反应共转移的电子数目是________。
II.水是生命之源,也是化学反应中的主角。请回答下列问题:
(1)已知:2 mol H2完全燃烧生成液态水时放出572 kJ的热量。
①若2 mol氢气完全燃烧生成水蒸气,则放出的热量________ (填“>”“<”或“=”)572 kJ。
②每克氢气燃烧生成液态水时放出的热量为________。
(2)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。a电极的电极反应式是____________________________。当a极转移0.3mol电子时,b极消耗标准状况下O2的体积为_________________mL。b极附近pH____(填“增大”、“减小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:(已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。)
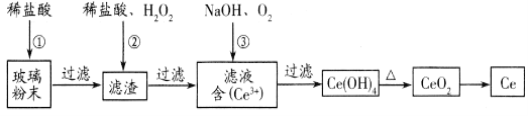
滤渣的成分是_____________________,反应②的离子方程式是_____________________________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为___________________________。
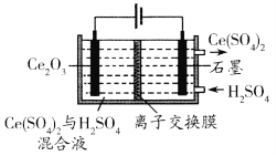
(3)利用电解方法也可以实现铈的回收。在酸性条件下电解Ce2O3(如图):阳极电极反应式为________________,离子交换膜为________ (填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化钙⑧ 氮气
A.③⑤⑦⑧B.⑤⑦⑧C.⑤⑧D.⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含一定量Na2O杂质的Na2O2试样,用下图所示的实验装置通过与纯净、干燥的CO2反应来测定试样中Na2O2的纯度。
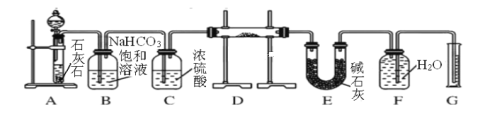
回答下列问题:
(1)按上图组装好实验装置后,首先应该进行的操作是______________。
(2)分液漏斗中所装试液是__________。
(3)装置D中发生反应的化学方程是:Na2O + CO2 = Na2CO3和____。
(4)E中碱石灰的作用是__________。
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则试样中Na2O2的含量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图像的说法中正确的是
A. 图① 表示可逆反应“CO(g)+H2O(g)
表示可逆反应“CO(g)+H2O(g)![]() CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B. 图② 以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
C. 图③ 表示碳酸钠溶液加水稀释时溶液的pH值变化
表示碳酸钠溶液加水稀释时溶液的pH值变化
D. 图④ 表示压强对可逆反应2A(g)+2B(g)
表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(1),示意图如下:
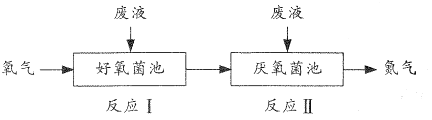
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H1=akJ·mol-1
反应Ⅱ:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) △H2=bkJ·mol-1
下列说法正确的是
A.两池发生的反应中,氮元素只被氧化
B.两池中投放的废液体积相等时,NH4+能完全转化为N2
C.常温常压下,反应Ⅱ中生成22.4 L N2转移的电子数为3.75NA
D.4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) △H=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0 mL于锥形瓶,加入10.0mL KI溶液(足量),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol/L的Na2S2O3标准液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是________________。
(2)步骤①反应的离子方程式是______________________________________。
(3)步骤③当锥形瓶中待测液的颜色由_________________________________即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为______________。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度_________(填“偏大”、“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度___________________(填“偏大”、“偏小”或“相等”)。
(6)下列有关滴定实验的说法正确的是_______。
A.检查酸性滴定管是否漏水,关闭活塞,向滴定管中注一定量水,观察尖嘴部分是否滴水
B.用标准液滴定待测液时,滴定前尖管处无气泡,滴定后有气泡,则测定结果偏大
C.酸碱中和反应无明显现象,可以用pH计来指示反应终点
D.滴定过程中滴加溶液速度不能太快,一般以每秒3~4滴为宜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)常作供氢剂,遇水蒸气剧烈反应。某小组设计如下实验制备氢化钙。下列说法错误的是( )
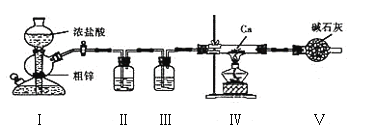
A. 装置I不可用于二氧化锰与浓盐酸反应制取氯气
B. 装置III、V所起作用相同
C. 直玻璃管加热前,用试管在末端收集气体并验纯
D. 试验结束后,可通过取样加水,根据气泡判断是否有CaH2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com