
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ③④ |
分析 ①同周期自左而右,非金属性增强.
②原子序数为15的元素是磷元素,主族元素最高正化合价等于原子最外层电子数.
③第二周期ⅣA族元素为碳元素,原子核电荷数一定为6,中子数不一定是6.
④原子序数为12的元素为镁元素,含有3个电子层、最外层含有2个电子,据此判断其在周期表中位置.
解答 解:①同周期自左而右,非金属性增强,所以ⅦA族元素是同周期中非金属性最强的元素,故①正确;
②主族元素最高正化合价等于原子最外层电子数,原子序数为15的元素是磷元素,最外层电子数为5,该元素的最高化合价为+5,故②错误;
③第二周期ⅣA族元素为碳元素,原子核电荷数一定为6,中子数不一定是6,如有核素614C,故③错误;
④原子序数为12的元素为Mg,位于周期表中第三周期ⅡA族,故④正确;
故选A.
点评 本题考查原子结构与元素的性质,侧重元素的位置与原子结构的关系、元素性质变化规律及原子构成的考查,明确元素周期律内容、元素周期表结构为解答关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
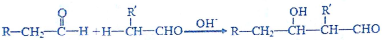
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肥皂水、矿泉水及食醋三种溶液的pH依次减小 | |
| B. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 | |
| C. | 食品袋中放入盛有硅胶和铁粉的透气小袋,是为了防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”、“汽车尾气催化净化”等方法可减少“雾霾”的发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
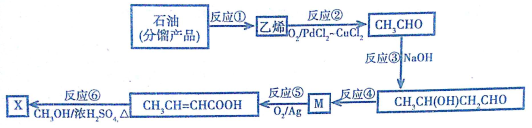
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | |
| B. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe2++NO↑+2H2O | |
| C. | Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
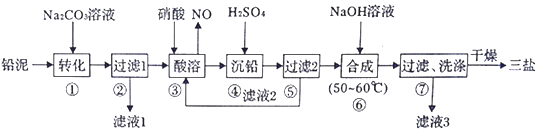
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
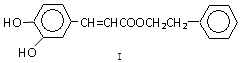

 或
或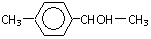 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液、加热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com