
【题目】下列各离子组在指定的溶液中能够大量共存的是
A.无色溶液中:Cu2+、K+、SCN、Cl
B.pH=11的NaOH 溶液中:CO![]() 、Na+、NO
、Na+、NO![]() 、SO
、SO![]()
C.由水电离出的 c(H+)=1.0×1013 mol·L1 的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
D.含有NO![]() 的溶液中:I- 、SO
的溶液中:I- 、SO![]() 、SO
、SO![]() 、H+
、H+
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是![]()
A.硬脂酸与乙醇的酯化反应:![]()
![]()
![]()
B.常温时,![]() 氨水的
氨水的![]() :
:![]()
C.由Na和Cl形成离子键的过程:![]()
![]()
![]()
D.电解精炼铜的阴极反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| 700 | 800 | 830 |
|
|
K |
|
|
|
|
|
下列有关叙述不正确的是![]()
![]()
A.该反应的化学方程式是![]()
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各
各![]() ,
,![]() 内温度升高到
内温度升高到![]() ,测得此时
,测得此时![]() 为
为![]() 时,推知此时反应为平衡状态
时,推知此时反应为平衡状态
D.如果平衡浓度符合关系式![]() ,判断此时的温度是
,判断此时的温度是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有CoOOH、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
I.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡,过滤,分离除去沉淀a。
II.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀b[主要成分是Na2Fe6(SO4)4(OH)12]。
III.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀c。
IV.III中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃ 煅烧,即得到Co2O3。
请回答:
(1)I 中,沉淀a的成分是_____,稀硫酸溶解CoCO3的化学方程式是_____, 加入Na2SO3溶液的主要作用是_________。
(2)根据图1、图2

①矿石粉末浸泡的适宜条件应是:温度_____、pH_____。
②图2中铜、钴浸出率下降的可能原因是_____。
(3)II中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO![]() +_____+_____== Cl- +_____+ _____
+_____+_____== Cl- +_____+ _____
(4)I中,检验铁元素完全除去的试剂是_____,实验现象是_____。
(5)I中,沉淀c的成分是CaF2、_____(填化学式)。
(6)V中,加入Na2CO3的作用是_____。
(7)V中,分离出纯净的CoC2O4·2H2O的操作是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式___________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为___________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量___________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比____________。②吸收后氨水的物质的量浓度_______________(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
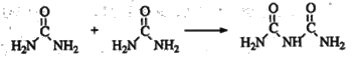 +NH3
+NH3
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据央广新闻报道,2016年我国河南桐柏县发现特大金矿,含金量近105吨可挖80年。除了发现的特大金矿,同时还发现大量天然碱、铅锌矿产资源。根据上述信息,回答下列问题:
(1)铅原子的价层电子排布式为__________,原子核外有__________个未成对电子。
(2)锌与镓(Ga)同周期,锌的第一电离能大于镓的第一电离能,其原因是________________。
(3)天然碱的化学式为Na2CO3·NaHCO3·2H2O。
(I)天然碱的晶体类型是__________;H2O的VSEPR模型为______________。
(Ⅱ)Na2CO3中存在的作用力类型主要有__________,CO32-中C的杂化类型为___________。
(4)金是贵重金属。冶金工业上,提取金的原理是2[Au(CN)2]一+Zn=2Au+[Zn(CN)4]2-。与CN一互为等电子体的离子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
(5)金晶体的晶胞结构如图所示。已知金的密度为ρ g·cm3,摩尔质量M(Au)=197g·mol-1,阿伏加德罗常数为NA。则晶体中金原子的配位数为_______,金原子(或粒子)的半径r=___pm(用含ρ和NA的代数式表示)。
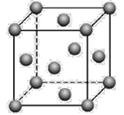
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1 和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1 周围产生细小气泡,C2 周围无明显现象;持续通电一段时间后,C2 周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:![]()
B.可以用两根铁钉代替铅笔芯完成实验
C.自制消毒剂的总反应为:NaCl+H2O ![]() NaClO+H2↑
NaClO+H2↑
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是PH3,其结构式为___________,下列有关PH3的说法错误的是___________。
a.PH3分子是极性分子
b.PH3分子稳定性低于NH3分子,因为N-H键键能高
c.一个PH3分子中,P原子核外有一对孤电子对
d.PH3沸点低于NH3沸点,因为P-H键键能低
(2)“荧光”产生的原理是Ca3P2在潮湿的空气中剧烈反应,写出该反应的化学方程式____________________。
(3)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H | 白磷分子结构 |
键能/(kJ·mol-1) | 213 | 436 | 322 |
|
则反应4PH3(g)![]() P4(g)+6H2(g) △H=___________ kJ· mol-1。
P4(g)+6H2(g) △H=___________ kJ· mol-1。
(4)某温度下,向容积为2L的密闭容器中通入2 mol PH3发生(3)中反应,5min后反应达平衡,测得此时H2的物质的量为1.5 mol,则用PH3表示的这段时间内的化学反应速率v(PH3)=__________;下列说法能表明该反应达到平衡状态的是___________。
A.混合气体的密度不变 B.6v(PH3)=4v(H2)
C.c(PH3):c(P4):c(H2)=4:1:6 D.混合气体的压强不变
(5)PH3有毒,白磷工厂常用Cu2+、Pd2+液相脱除PH3:PH3+2O2![]() H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:
H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:

(I)由图可知,富氧有利于____________(选填“延长”或“缩短”)催化作用的持续时间。
(Ⅱ)随着反应进行,PH3的净化效率急剧降低的原因可能为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.常温下,![]() 的氢氧化钠溶液中加入10mL
的氢氧化钠溶液中加入10mL ![]() 的HA,所得溶液
的HA,所得溶液![]()
B.![]() 时,
时,![]() 与
与![]() 的氯化铵溶液的pH前者大
的氯化铵溶液的pH前者大
C.室温时浓度均为![]() 的
的![]() 和
和![]() 的混合液,pH为10,则
的混合液,pH为10,则![]()
D.![]() 溶液:
溶液:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com