
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3 的反应:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
(1)从反应开始到平衡,v(SiCl4)= 。
(2)该反应的平衡常数表达式为K= ,温度升高,K值增大,则Q 0(填“>”、“<”或“=”)。
 (3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为 。
(5)平衡后,将容器的体积缩为10 L,再次达到平衡时,
H2的物质的量浓度范围为 。
【知识点】化学反应速率、化学平衡的移动 G1 G2 G5
【答案解析】
(1)0.075 mol·L-1·min-1 (2)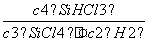 ;> (3)减小 (4)89.6 L
;> (3)减小 (4)89.6 L
(5)0.1 mol·L-1<c(H2)<0.2 mol·L-1
解析:(1)根据同一反应的同一速率,速率比等于方程式的系数比:v(SiCl4)=3/4v(SiCl3)= mol·L-1·min-1
mol·L-1·min-1
(2)利用平衡常数的定义写出,注意反应物中硅为固体。温度升高,K值增大,说明平衡正向移动,正方向是吸热的,Q>0。
(3)平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),相当于加压,由于加压平衡正向移动,所以当反应再次达到平衡时,与原平衡相比较,H2的体积分数将减小。
(4)平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1,根据方程式知氢气的浓度减小了0.2 mol·L-1÷2=0.1 mol·L-1,所以开始氢气的浓度为0.1mol·L-1+0.1mol·L-1=0.2mol·L-1,原容器中,通入H2的体积(标准状况下)为:0.2mol·L-1×20L×22.4L/mol=89.6 L
平衡后,将容器的体积缩为10 L,再次达到平衡时,
(5)平衡后,将容器的体积缩为10 L,假设平衡不移动c(H2)=0.2 mol·L-1,但由于加压平衡右移c(H2)<0.2 mol·L-1,根据勒夏特列原理c(H2)>0.1mol·L-1
所以H2的物质的量浓度范围为0.1 mol·L-1<c(H2)<0.2 mol·L-1
【思路点拨】本题考查化学反应速率、化学平衡的移动,计算式要认真,关键是理解平衡移动原理。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
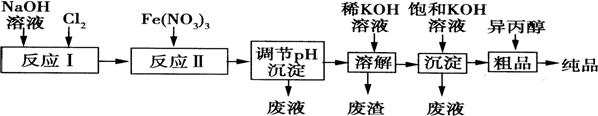
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整
pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种可再生燃料。在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
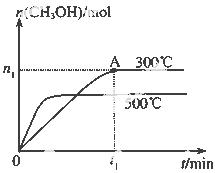
(1)该反应的△H 0 (填>、<或=)
(2)300℃时,0-t1 min内 CH3OH的平均生成速率为
(3)若要提高甲醇的产率,可采取的措施有_________ 。(填字母)
A.缩小容器体积 B.降低温度
C.升高温度 D.使用合适的催化剂
E.甲醇从混合体系中分离出来
(4)300℃时,CO、H2的起始物质的量分别为2mol和3mol,若图中n1数据为0.5mol,试计算300℃下,该反应的平衡常数(写出计算过程,保留两位有效数字)
(5)工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应N2(g)+O2(g)==2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
A.降低体系温度 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
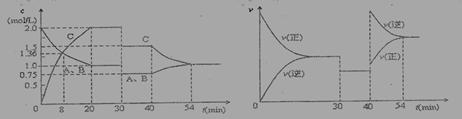
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在容积为 2L 的密闭容器中,发生反应 2X(g) + Y(g)  2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
①升高温度,W 的体积分数减小,△H 增大
②以 Y 的浓度变化表示的反应速率为 0.01 mol/(L·s)
③在其它条件不变的情况下,增加 1 mol X ,则 X 和 Y 的转化率均提高
④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动
⑤再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大。
A、①⑤ B、⑤ C、②③④ D、④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,下列关于实验现象的描述正确的是 ( )
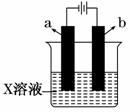
| a电极 | b电极 | X溶液 | 实验现象 | |
| A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
| B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
| C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
| D | 石墨 | 石墨 | HCl | a电极放出无色气体,b电极放出无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某酸H2B在水溶液中存在下列关系:
①H2B H++HB-,②HB-
H++HB-,②HB- H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是 ( )
H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是 ( )
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时有pH=12的NaOH溶液100mL,要使它的pH为11.(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加0.01mol/L 盐酸,应加 mL;
(4)如果加0.01mol/L 醋酸,所加体积比0.01mol/L 盐酸所用体积 (填“多”、“少”、“一样”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com