
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2固体中含有的阴离子总数为0.1NA | |
| C. | 5.6gFe与标准状况下2.24L氯气充分反应失去电子数为0.3NA | |
| D. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
分析 A.氯气与水的反应为可逆反应,不能进行彻底;
B.硫化钠和过氧化钠的摩尔质量都是78g/mol,过氧化钠中的阴离子为过氧根离子;
C.根据铁和氯气的物质的量判断过量,然后根据不足的量进行计算;
D.氟化氢的沸点是19.4℃,在标准状况下是液体,所以不能用气体摩尔体积来计算;
解答 解:A.氯气与水的反应为可逆反应,不能进行彻底,故0.1mol Cl2溶于水,转移的电子数目小于0.1NA,故A错误;
B.7.8g硫化钠和7.8g过氧化钠的物质的量均为0.1mol,0.1mol硫化钠、过氧化钠中都含有0.1mol阴离子,含有的阴离子数目均为0.1NA,故B正确;
C.5.6g铁的物质的量是0.1mol,完全反应消耗氯气的物质的量为0.15mol,而标况下2.24L氯气的物质的量是0.1mol,显然氯气不足,转移的电子的物质的量为0.2mol,失去的电子数为0.2NA,故C错误;
D.氟化氢的沸点是19.4℃,在标准状况下是液体,33.6L氟化氢物质的量不是1.5mol,不能用气体摩尔体积来计算,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常的应用,主要考查气体摩尔体积的体积应用,质量换算物质的量计算微粒数,注意氢氟酸标况下的状态,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
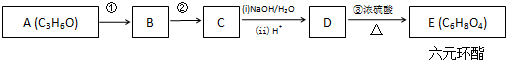
 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
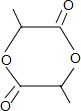
| A. | 丙烷分子的比例模型示意图为 | |
| B. | 按系统命名法,(CH3)2CHCH(CH3)CH=CH2的名称为2,3-二甲基-4-戊烯 | |
| C. | 乙烯的结构简式:C2H4 | |
| D. | 乙醇的最简式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )
四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )| A. | 1molW的单质在足量空气中燃烧转移电子数是6NA | |
| B. | 含Y元素的盐溶液可能显酸性,也可能显碱性 | |
| C. | Z元素的单质和氧化物不能与任何酸发生反应 | |
| D. | X与H、O元素形成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性SiH4<PH3<NH3<H2O | B. | 熔点:Na>K>Rb>Cs | ||
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | D. | 半径:K+>Na+>O2->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
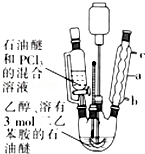 亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl
亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl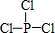 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com