
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
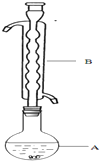
分析 (1)根据装置图可知,仪器B为球形冷凝管,结烧瓶中的液体进行冷凝回流,硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中,硫在酒精中微溶,可以增大接触面积,提高反应速率;
(2)由于S2O32?具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;
(3)碘单质滴定亚硫酸钠反应,碘单质遇到淀粉溶液变蓝色,滴入最后一滴溶液变蓝色且半分钟不褪色证明滴定反应达到终点,碘水有氧化性,能腐蚀橡胶管;依据化学反应方程式2S2O32-+I2═S4O42-+2I-计算即可,测定样品的纯度就是以碘标准溶液为标准的,如果滴定终点没有控制好,碘标准溶液滴加过量也会和亚硫酸钠反应.
解答 解:(1)根据装置图可知,仪器B为球形冷凝管,结烧瓶中的液体进行冷凝回流,硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接触,加快反应速率
故答案为:球形冷凝管;增加反应物接触面积,提高反应速率;
(2)S2O32?具有还原性,能够被氧气氧化成硫酸根离子,滤液中除Na2S2O3和可能未反应完全的Na2SO3外,存在被氧化产物硫酸钠,所以可能存在的杂质是硫酸钠,
故答案为:Na2SO4;
(3)碘单质滴定亚硫酸钠反应,碘单质遇到淀粉溶液变蓝色,滴入最后一滴溶液变蓝色且半分钟不褪色证明滴定反应达到终点,碘水有氧化性,能腐蚀橡胶管,所以碘水应放在酸式滴定管中进行滴定,根据题中表中的数据可知,第二次数据偏差较大,所以取一、三两次实验的数据,所以用去的碘水的体积为$\frac{30.78+30.82}{2}$mL=30.8mL,碘的物质的量为:0.0500mol•L-l×0.0308L=0.00154mol,
2S2O32-+I2═S4O62-+2I-,
2 1
x 0.00154mol
解x=0.00308mol,故Na2S2O3•5H2O的物质的量为0.00308mol,质量为:0.00308×248g/mol=0.7638g,
则称取7.40g产品,配制成250mL溶液中,Na2S2O3•5H2O的质量为=0.7638g×$\frac{250}{25}$=7.638g
故产品的纯度为:$\frac{7.638g}{7.40g}$×100%=103.2%,
碘单质有强的氧化性,Na2SO3具有还原性,Na2SO3会和I2发生反应,从而影响纯度,
故答案为:淀粉溶液;酸式;103.2%;含有的Na2SO3也会和I2发生反应,从而影响纯度.
点评 本题考查了试剂的作用、物质的推断、滴定的计算、方程式的书写等知识,滴定实验的数据处理和计算方法是解题关键,题目难度较大,注意关系式的应用.


科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Mg2+、SO42-、Cl- | B. | NH4+、Na+、Cl-、OH- | ||
| C. | K+、Na+、SO42-、NO3- | D. | H+、Cl-、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和Cl2恰好完全反应 | B. | 生成99gFeCl3 | ||
| C. | 会有9.33gFe过量 | D. | 会有17.75gCl2过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和氯化铁溶液反应:Fe3++Fe═2Fe2+ | |
| B. | 醋酸和氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| C. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+H2O | |
| D. | 氢氧化铁和盐酸反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )| A. | 石墨电极上发生氧化反应 | |
| B. | 根据图示,物质A为CO2 | |
| C. | 为增强污水的导电能力,可向污水中加入适量乙醇 | |
| D. | 甲烷燃料电池中CO32-向空气一极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属.请回答下列问题
A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
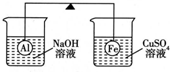 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )| A. | 铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡 | |
| B. | 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉 | |
| C. | 反应后去掉两烧杯,杠杆仍平衡 | |
| D. | 右边球上出现红色,左边溶液的碱性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com