
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将 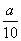 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:
 KMnO4+
KMnO4+ FeSO4+
FeSO4+ H2SO4===
H2SO4=== Fe2(SO4)3+
Fe2(SO4)3+ MnSO4+
MnSO4+ K2SO4+
K2SO4+ H2O
H2O
(2)在滴定实验中不能选择________式滴定管,理由是________________________________________________________________________
________________________________________________________________________;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为________和________;
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一________(填“准确”、“不准确”或“不一定准确”),理由是_________________;
②方案二________(填“准确”、“不准确”或“不一定准确”),理由是________________________________________________________________________
________________________________________________________________________。
答案 (1)2 10 8 5 2 1 8
(2)碱 酸性KMnO4是强氧化剂,会腐蚀胶管
(3)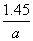
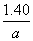
(4)①不一定准确 如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确
②不一定准确 如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确
解析 (1)分析该氧化还原反应的化合价,找出化合价发生变化的各元素,利用化合价的升降相等,配平化学方程式:
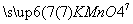 →
→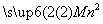 SO4
SO4 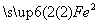 SO4→
SO4→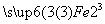 (SO4)3
(SO4)3
(2)由于酸性高锰酸钾溶液具有强氧化性,能腐蚀碱式滴定管的胶管,因此不能选择碱式滴定管。
(3)根据方案一中的测定结果计算:
n(Fe)=n(H2)=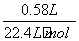
因此m(Fe)=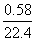 mol×56 g·mol-1=1.45 g
mol×56 g·mol-1=1.45 g
故铁片中铁的质量分数为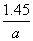 ;
;
根据方案二中的测定结果计算:
根据(1)中反应方程式:
2KMnO4~10FeSO4~10Fe
n(Fe)=5n(KMnO4)
=5×0.020 00 mol·L-1×0.025 L
=0.002 5 mol
铁片中铁的质量分数为
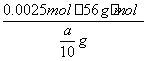 =
=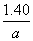 。
。
(4)①方案一不一定准确,因为不能确定Fe片中是否含有和稀硫酸反应放出H2的杂质,若有则测定结果偏高。
②方案二是利用Fe2+消耗KMnO4的物质的量的多少,求出Fe的质量分数,而铁片中是否含有和酸性KMnO4溶液反应的杂质也不能确定,另外铁片中若有+3价的Fe的杂质,用KMnO4也测定不出来。因此方案二也不一定准确。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
用下图所示装置检验乙烯时不需要除杂的是( )
| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: (1)Zn(s)+1/2O2(g)==ZnO(s);ΔH=-348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)== Ag2O(s);ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于
A.-317.3kJ/mol B.-379.3kJ/mol
C.-332.8 kJ/mol D.+317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= ,在80℃时该反应的平衡常数K值为 (保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
N2O4的转化率越高
NO2的产量越大
N2O4与NO2的浓度之比越大
正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施
 增大N2O4起始浓度
增大N2O4起始浓度
向混合气中通入NO2
(C) 使用高效催化剂
(D) 升高温度
(6)如图是80℃时容器中N2O4浓度的变化
图,请在该图中补画出该反应在60℃反
应时N2O4浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一份CuO和Cu2O的混合物,用H2还原法测定其中的CuO质量x g,实验中可以测定以下数据:①W:混合物的质量(g)、②W(H2O):生成水的质量(g)、③W(Cu):生成 Cu的质量(g)、④V(H2):标准状况下消耗H2的体积(L)。
(已知摩尔质量:Cu:64 g·mol-1、CuO:80 g·mol-1、Cu2O:144 g·mol-1、H2O:18 g·mol-1)
(1)为了计算x至少需要测定上述4个数据中的____个,这几个数据的组合共有________种。请将这些组合一一填入下列空格中。
说明:①选用W、W(H2O)、W(Cu)、V(H2)表示,不必列出具体算式。
②每个空格中填一种组合,有几种组合就填几种,不必填满。
(2)从上述组合中选出一个含W数据的求x的计算式:
________________________________________________。
(3)以上数据组合中易于取得的一组是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
依据元素周期表及元素周期律,下列推断正确的是
( )
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl、HBr、HI的热稳定性逐渐增强
D.若M+和R2-的核外电子层结构相同,则离子半径:M+>R2-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电子云的叙述中,正确的是( )
A.电子云形象地表示了电子在核外某处单位体积内出现的概率
B.电子云直观地表示了核外电子的数目
C.1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零
D.电子云是电子绕核运动形成的一团带负电荷的云雾
查看答案和解析>>
科目:高中化学 来源: 题型:
在配制溶液时,为防止溶液浑浊,需加入某一溶液,下列各组溶液配制时所加溶液(括号内为溶质)正确的是( )
A.Fe2(SO4)3(HCl) B.Na2CO3(NaOH)
C.AlCl3(H2SO4) D.CH3COONa(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
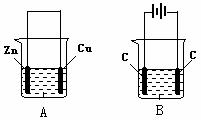
(1)A, B两个装置中,属于原电池的是 (填标号,下同)。
(2)B池中,右边C是 极,电极反应式为: ;
(3)A池中溶解了6.5g锌时,转移了 mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com