
| A. | 4.6g 由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA | |
| B. | 7.4g 丁醇中存在的共价键总数为1.3NA | |
| C. | 铁与稀硝酸反应时,生产0.1mol NO转移的电子数为0.3NA | |
| D. | 0.2 g $D_2^{16}O$中含有的质子数,中子数,电子数均为0.1NA |
分析 A、NO2和N2O4的最简式均为NO2;
B、求出丁醇的物质的量,然后根据1mol丁醇中含14mol共价键;
C、反应中氮元素由+5价变为+2价来分析;
D、求出重水的物质的量,然后根据重水中含质子数、中子数、电子数均为10个来分析.
解答 解:A、NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为n=$\frac{4.6g}{46g/mol}$=0.1mol,故含0.3NA个原子,故A正确;
B、7.4g丁醇的物质的量为0.1mol,而1mol丁醇中含14mol共价键,故0.1mol丁醇中含1.4NA个共价键,故B错误;
C、反应中氮元素由+5价变为+2价来分析,故当生成0.1molNO时转移0.3mol电子即0.3NA个,故C正确;
D、0.2g重水的物质的量为0.01mol,而重水中含质子数、中子数、电子数均为10个,故0.01mol重水中含中子、质子和电子均为0.1NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钠的还原性很强,能被多种氧化剂氧化 | |
| B. | 钠的化学性质非常活泼,在自然界中钠元素以化合态存在 | |
| C. | 钠是一种灰黑色固体 | |
| D. | 钠的质地软,可用小刀切割 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
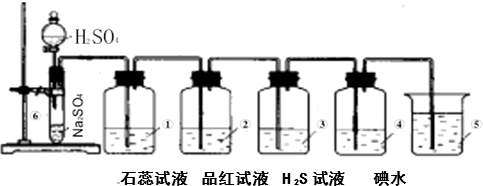
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )
某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-=Fe3+ | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HX、HY、HZ的酸性依次增强 | B. | 离子浓度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 电离常数:K(HZ)<K(HY) | D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
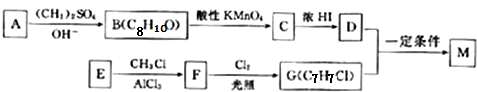
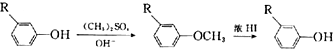
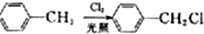
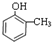 ;E→F的反应类型为取代反应.
;E→F的反应类型为取代反应.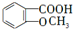 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$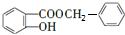 +HCl
+HCl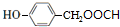 (写结构简式).
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备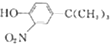 的合成路线:
的合成路线: $→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$
$→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$ $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$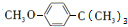 $→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$
$→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$ $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$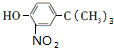 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
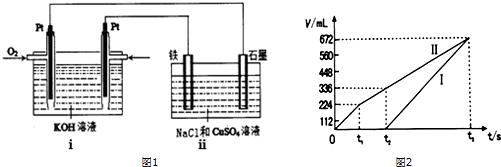
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 | |
| B. | 铜与浓硫酸反应产生二氧化硫,而锌与浓硫酸反应产生氢气 | |
| C. | 二氧化硅是酸性氧化物能和烧碱溶液反应 | |
| D. | 在常温下,浓硫酸不与铜反应,是因为铜被钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
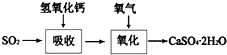
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com