
| A. | 原子数之比为3:2 | B. | 同温同压下密度比是2:3 | ||
| C. | 同温同压下质量比是3:2 | D. | 标准状况下体积比是2:3 |
分析 A.根据N=nNA结合分子构成计算原子个数之比;
B.同温同压下,气体摩尔体积相等,根据ρ=$\frac{M}{{V}_{m}}$计算二者密度之比;
C.根据m=nM计算二者质量之比;
D.根据V=nVm计算其体积之比.
解答 解:A.0.3mol氧气和0.2mol臭氧气(O3)含有原子数目之比为0.3mol×2:0.2mol×3=1:1,故A错误;
B.同温同压下,气体摩尔体积相等,根据ρ=$\frac{M}{{V}_{m}}$可知,二者密度之比为32g/mol:48g/mol=2:3,故B正确;
C.同温同压下,二者质量比是0.3mol×32g/mol:0.2mol×48g/mol=1:1,故C错误;
D.根据V=nVm可知,标况下0.3mol氧气和0.2mol臭氧气(O3)的体积之比为0.3mol:0.2mol=3:2,故D错误,
故选:B.
点评 本题考查物质的量计算,比较基础,注意对公式的理解与灵活应用,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的原子数为0.4NA | |
| B. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| C. | 含2mol H2SO4的浓硫酸与足量铜粉完全反应,生成气体分子的数目为2NA | |
| D. | 标准状况下,11.2L CCl4中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液, 振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②, 振荡 | ③ | 存在Fe2+ |
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 | 5.4 |
| 完全沉淀 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.
 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
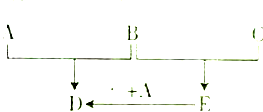 已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):
已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com