
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
分析 (1)盐酸浓度、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应;根据甲中金属与氢气的体积定比关系计算生成336mL氢气需要金属的质量,确定乙中盐酸与金属是否恰好反应;
(2)乙、丙中盐酸完全,可以根据反应生成氢气体积计算盐酸的物质的量浓度,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,根据氢元素守恒可知n(HCl)=2n(H2),据此计算;
(3)甲中盐酸有剩余,金属完全反应,此时生成氢气280mL,故可以根据甲组数据计算金属的物质的量之比,设镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒列方程计算x、y的值,据此解答.
解答 解:(1)盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,
根据甲可知,生成336mL氢气需要金属的质量为:255mg×$\frac{336mL}{280mL}$=306mg,故乙中金属有剩余,乙中盐酸不足,
故答案为:乙;因甲反应后的溶液中再加合金还能继续反应,说明甲中盐酸有剩余,若乙中盐酸恰好完全反应或有剩余,则产生的氢气应为$\frac{385}{255}$×280mL=423 mL>336 mL,故说明乙中盐酸不足;
(2)乙、丙中盐酸完全反应,可以根据反应生成氢气体积计算盐酸的物质的量浓度,盐酸完全反应生成氢气336mL,氢气的物质的量为:$\frac{0.336L}{22.4L/mol}$=0.015mol,根据氢元素守恒可知:n(HCl)=2n(H2)=2×0.015mol=0.03mol,故盐酸的物质的量浓度为:$\frac{0.03mol}{0.02L}$=1.5mol/L,
故答案为:乙或丙;1.5mol/L;
(3)甲中盐酸有剩余,金属完全反应,此时生成氢气280mL,故可以根据甲组数据计算金属的物质的量之比,设镁、铝的物质的量分别为xmol、ymol,根据二者质量可知:①24x+27y=0.255,根据电子转移守恒有:②2x+3y=$\frac{0.28L}{22.4L/mol}$×2,
根据①②联立解得:x=0.005、y=0.005,
所以合金中镁与铝的物质的量之比为:0.005mol:0.005mol=1:1,
故答案为:甲;1:1.
点评 本题考查混合物反应的计算,题目难度中等,根据表中数据关系判断反应的过量问题是关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 向四氧化三铁中加入稀硫酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2至沉淀质量最大Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4+2H2O | |
| C. | 向CuSO4溶液中加入金属钠:2Na+Cu2+═2Na ++Cu | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、NH3•H2O、H3PO4 | B. | Cu(OH)2、CH3COOH、C2H5OH | ||
| C. | H2SO3、Ba(OH)2、BaSO4 | D. | H2SiO3、H2S、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
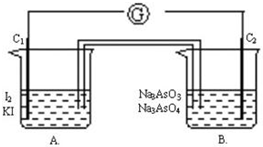 根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.
根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.685mol•L-1 | B. | 3.370 mol•L-1 | C. | 22.49 mol•L-1 | D. | 11.24 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | K+、H+、CO32-、HCO3- | ||
| C. | Ca2+、Ba2+、Cl-、HCO3- | D. | Na+、Ba2+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com