
| A. | 溶解、过滤、蒸发 | B. | 溶解、过滤、洗涤、干燥 | ||
| C. | 溶解、过滤、结晶 | D. | 溶解、结晶、干燥 |
分析 剩余物质中有KCl(或含KClO3)和MnO2,要想回收MnO2,应利用KCl(或含KClO3)溶于水,但MnO2不溶于水,以此来解答.
解答 解:实验室加热氯酸钾与MnO2的混合物制氧气,发生2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,剩余物质中有KCl(或含KClO3)和MnO2,要想回收MnO2,要利用KCl(或含KClO3)溶于水,但MnO2不溶于水,应先将混合物溶解,然后过滤得MnO2固体,然后将MnO2固体洗涤并干燥即可,
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:实验题
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| C. | 铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
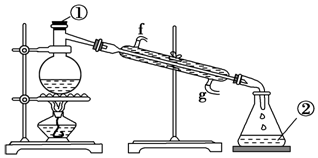
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 硅胶可做袋装食品的干燥剂 | |
| D. | 晶体硅可用于制作半导体材料与其熔点高硬度大无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
| 压强(kPa) | 200 | 500 | 1 000 |
| B的浓度(mol•L-1) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的纯碱溶液中含有0.1NA个Na+ | |
| B. | 常温常压下,23g NO2中含有NA个氧原子 | |
| C. | 常温常压下,22.4L CCl4含有个NACCl4分子 | |
| D. | 1molFe与足量的盐酸反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
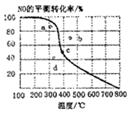 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com