
| A. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c({CH}_{3}C{OO}^{-})}{c({CH}_{3}COOH)}$的值增大到原来的100倍 | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-═AlO2-+NH3•H2O+2BaSO4↓ | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
分析 A.根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$结合溶液中氢离子的浓度变化分析;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2;
C.根据质子守恒分析;
D.0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应,生成NaA,若HA为弱酸,则A-会水解,据此分析.
解答 解:A.常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(H+)变为原来的$\frac{1}{100}$,由于Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$不变,所以$\frac{c({CH}_{3}C{OO}^{-})}{c({CH}_{3}COOH)}$的值增大到原来的100倍,故A正确;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故B错误;
C.常温下,0.1 mol•L-1Na2S溶液中水电离的氢离子的总浓度等于水电离出来的氢氧根离子的总浓度,所以溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C正确;
D.0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应,生成NaA,若HA为弱酸,则A-会水解,A-的浓度减小,所以溶液中c(Na+)>c(A-),故D错误.
故选A.
点评 本题考查了弱电解质的电离、盐的水解、电离常数的应用等,题目难度中等,注意把握溶液中离子浓度大小比较方法和物料守恒及电荷守恒,侧重于考查学生的分析能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 有大量SO32-溶液中:Na+、NH4+、SO42-、NO3- | |
| B. | 强碱性溶液中:NH4+、Ca2+、NO3-、Cl- | |
| C. | 强酸性溶液中:Cu2+、Mg2+、HCO3-、SO42- | |
| D. | 有大量Ba2+溶液中:K+、Ca2+、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液盛装在带有橡胶塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 光导纤维中所用材料为晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A+B═C+D | B. | 2A+B═2C+D | C. | A+B═2C+D | D. | 2A+B═C+2D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
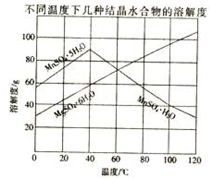 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | SO2(mol) | O2(mol) | N(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A. | 在上述条件下反应生成1molSO3气体放热98.5 kJ | |
| B. | Q1=2Q2=2Q3=197 kJ | |
| C. | 上述条件下1mol O2参加反应放出的热量为197 kJ/mol | |
| D. | Q2<Q3<Q1<197kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com