
| A. | ①③⑤ | B. | ①③⑥ | C. | ②④⑥ | D. | ②③⑤ |
分析 元素周期表的前六周期已填满,所容纳的元素种数是:2+8+8+18+18+32=86,而前七周期可容纳元素的种数是:86+32=118;可见116号元素位于第七周期ⅥA族,属于氧族元素,以此进行分析.
解答 解:①元素周期表的前六周期已填满,所容纳的元素种数是:2+8+8+18+18+32=86,而前七周期可容纳元素的种数是:86+32=118;可见116号元素位于第七周期ⅥA族,故①正确;
②周期表总从上到下元素的金属性逐渐增强,已知第六周期的Po元素为金属元素,则第116号元素为金属元素,故②错误;
③116号元素位于第七周期ⅥA族,最外层电子数为6,故③正确;
④第六周期的Po元素具有放射性,则同主族第七周期元素也具有放射性,故④错误;
⑤116号元素位于第七周期ⅥA族,属于氧族元素,故⑤正确;
⑥116号元素位于第七周期ⅥA族,不属于卤素,故⑥错误.
故选A.
点评 本题考查原子结构和推断,题目难度不大,注意周期表中各周期元素的种类.


科目:高中化学 来源: 题型:选择题
| A. | 少量铁粉加入稀盐酸中:Fe+2H+=Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| D. | 重铬酸钾溶液中:Cr2O72-+H2O?2CrO42-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 相同条件下,不同的可逆反应,其反应的限度不同 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲烷分子中的四个氢原子都可以被取代.甲烷分子的四个氢原子都被乙烯基(CH2═CH-)取代得到的产物的结构如图所示.下列对所得分子的描述中不正确的是( )
甲烷分子中的四个氢原子都可以被取代.甲烷分子的四个氢原子都被乙烯基(CH2═CH-)取代得到的产物的结构如图所示.下列对所得分子的描述中不正确的是( )| A. | 分子式为:C9H12 | |
| B. | 1mol此分子在一定条件下最多能与4mol H2发生加成反应 | |
| C. | 所有碳原子都在同一平面上 | |
| D. | 此物质属于烯烃类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体元素最外层电子数均为8个 | |
| B. | 原子最外层少于4个电子的元素均是金属元素 | |
| C. | 相同条件下,H2O的沸点比H2S高是因为水分子间含有氢键 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
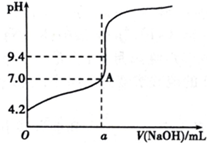 现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:
现用盐酸标准溶液来测定NaOH溶液的浓度.滴定时有下列操作:| 滴定次数 | 1 | 2 | 3 | 4 |
| V(标准溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com