

| Br2/CCl4 |
| NaOH/H2O |
| O2Cu |
| O2/催化剂 |
| 一定条件 |
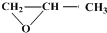 发生类似反应①的反应,试写出其中一种产物的结构简式
发生类似反应①的反应,试写出其中一种产物的结构简式 ,Ⅳ发生催化氧化生成Ⅲ为
,Ⅳ发生催化氧化生成Ⅲ为 ,Ⅲ进一步发生氧化反应生成Ⅱ为
,Ⅲ进一步发生氧化反应生成Ⅱ为 ,Ⅱ发生消去反应生成Ⅰ,则Ⅰ为
,Ⅱ发生消去反应生成Ⅰ,则Ⅰ为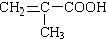 ,据此解答.
,据此解答. ,Ⅳ发生催化氧化生成Ⅲ为
,Ⅳ发生催化氧化生成Ⅲ为 ,Ⅲ进一步发生氧化反应生成Ⅱ为
,Ⅲ进一步发生氧化反应生成Ⅱ为 ,Ⅱ发生消去反应生成Ⅰ,则Ⅰ为
,Ⅱ发生消去反应生成Ⅰ,则Ⅰ为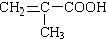 ,
,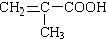 ,可知其分子式为C4H6O2;由化合物V的结构可知,其含氧官能团的为:酯基、羟基,故答案为:C4H6O2;酯基、羟基;
,可知其分子式为C4H6O2;由化合物V的结构可知,其含氧官能团的为:酯基、羟基,故答案为:C4H6O2;酯基、羟基;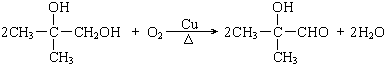 ,
, ;
; )的一种同分异构体,能发生分子内酯化反生成五元环状化合物,该同分异构体的结构简式为HOCH2CH2CH2COOH,由Ⅱ→Ⅰ是醇发生的消去反应,故答案为:HOCH2CH2CH2COOH;消去反应;
)的一种同分异构体,能发生分子内酯化反生成五元环状化合物,该同分异构体的结构简式为HOCH2CH2CH2COOH,由Ⅱ→Ⅰ是醇发生的消去反应,故答案为:HOCH2CH2CH2COOH;消去反应; 发生类似反应①的反应,产物的结构式为
发生类似反应①的反应,产物的结构式为 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、NaAlO2溶液中通入少量二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、碳酸镁和盐酸混合:CO32-+2H+=CO2↑+H2O |
| C、NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO |
| D、碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
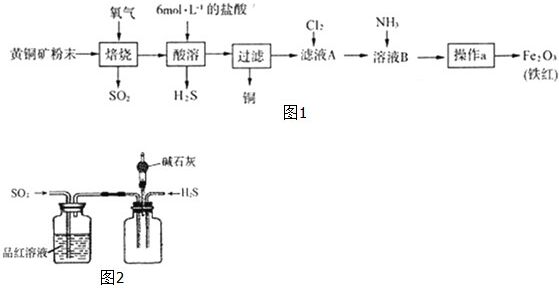
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
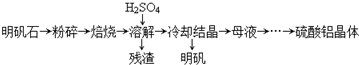
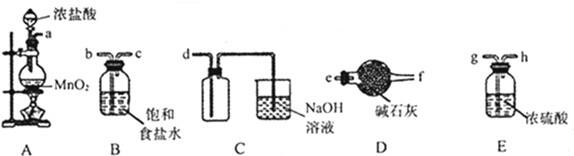
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
科目:高中化学 来源: 题型:
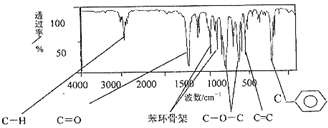
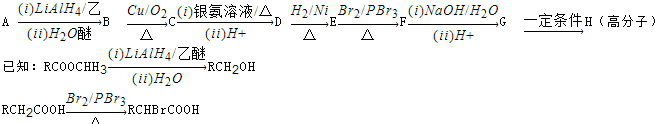
查看答案和解析>>
科目:高中化学 来源: 题型:

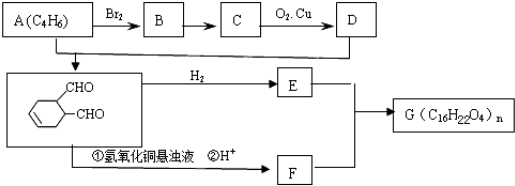
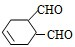 中含有的官能团的名称是
中含有的官能团的名称是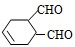 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有③ |
| C、①④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com