
 如图为原电池装置示意图:
如图为原电池装置示意图:分析 (1)该原电池中,电解质溶液为稀硫酸时,锌易失电子作负极;
(2)若A为铜片,B为石墨棒,电解质为FeCl3溶液,Cu易失电子作负极、石墨作正极,负极上铜失电子生成铜离子、正极上铁离子得电子生成亚铁离子;
(3)碱性燃料电池的总反应为燃料与氧气的反应,根据电极方程式中电子与反应物的关系计算.
解答 解:(1)该原电池中,电解质溶液为稀硫酸时,锌易失电子作负极,负极的电极反应为Zn-2e-=Zn2+;
故答案为:Zn-2e-=Zn2+;
(2)若A为铜片,B为石墨棒,电解质为FeCl3溶液,Cu易失电子作负极、石墨作正极,负极上铜失电子生成铜离子、正极上铁离子得电子生成亚铁离子,则正极的电极方程式为:Fe3++e-=Fe2+;
故答案为:负;Fe3++e-=Fe2+;
(3)在原电池中失电子的一极为负极,得电子的一极为正极,在氢氧燃料电池中,总反应为氢气和氧气反应生成水,所以电池反应式为2H2+O2=2H2O,正极反应为O2+4e-+2H2O═4OH-,所以当外电路有6.02×1022个电子通过,即转移0.1mol电子时,消耗氧气为0.025mol,其体积在标准状况下为0.56L;
故答案为:2H2+O2=2H2O;0.56.
点评 本题综合考查了原电池知识,题目难度中等,侧重于学生的分析能力和电化学知识的综合理解和运用能力的考查,注意把握电极的判断以及电极方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,原溶液含有SO42- | |
| B. | 某溶液先用稀硝酸酸化,再加入AgNO3溶液后有白色沉淀生成,证明原溶液中含有Cl- | |
| C. | 加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 向某溶液中加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色,说明原溶液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 297 | B. | 179 | C. | 118 | D. | 61 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NO3-、OH- | B. | K+、NO3-、SO42- | C. | Na+、Fe3+、Cl- | D. | Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .分别写出②和⑦、③和⑧化合产物的电子式
.分别写出②和⑦、③和⑧化合产物的电子式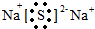 、
、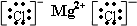 .⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).
.⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com