
下列关于物质分类的说法正确的是
A.根据是否具有丁达尔现象把分散系分为溶液、胶体、浊液
B.根据在水溶液里或熔化状态下是否导电把物质分为电解质、非电解质
C.凡是含有碳元素的物质为有机物,不含碳元素的物质为无机物
D.根据密度大小把金属分为轻金属和重金属
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:2014-2015学年湖南省益阳市高三四月调研考试理综化学试卷(解析版) 题型:选择题
有一种基于乙醇酸性燃料电池原理设计的酒精检测仪,其原理是通过将乙醇氧化为乙酸来测定血液中乙醇的含量。下列有关说法正确的是
A.电池工作时消耗5.6 L O2,转移电子为1 mol
B.检测时,电解质溶液中的H+向负极移动
C.正极上发生的反应为:O2+4e-+2H2O=4OH-
D.负极上发生的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查(二)化学试卷(解析版) 题型:简答题
(14分)氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_____。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为_____
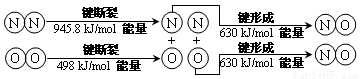
则该反应的热化学方程式为_________________________。
(3)工业合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
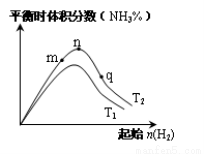
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是________点。
②T2条件下,在2 L的密闭容器中,充入x mol N2和y mol H2时,3 min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=_______;该反应的平衡常数的值K =_______。
③图像中T2________T1(填“高于”、“低于”、“等于”或“无法确定”)。
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率。写出电化学合成过程中发生还原反应的电极方程式:___________________________________。
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
编 号 | ① | ② | ③ | ④ |
稀硝酸体积/mL | 100 mL | 200 mL | 300 mL | 400 mL |
剩余金属/g | 18.0 g | 9.6 g | 0 | 0 |
NO体积/L(标准状况下) | 2.24 L | 4.48 L | 6.72 L | V |
下列有关分析推断正确的是____________。
A.硝酸起始浓度为4 mol/L B.①中溶解了5.6 g Fe
C.③中n(Cu2+) = 0.15 mol D.④中V = 6.72 L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列应用不涉及氧化还原反应的是
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:选择题
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:填空题
X、Y、Z、R为短周期元素且原子序数依次增大。X、R原子核外电子层数等于其最外层电子数,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用。另有M元素位于周期表的第4周期第6列。请回答下列问题:
(1)上述5种元素中,电负性最大的是(填名称)_____,X3Z+的VSEPR模型名称是______。
(2)M基态原子的电子排布式是______________。
(3)R的单质为面心立方最密堆积(见图),则一个晶胞中R原子数为 ,R的配位数是 。
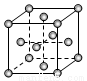
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
SO2有毒,但葡萄酒里都含有SO2,起保鲜、杀菌和抗氧化作用。下列说法不正确的是
A.葡萄酒中的SO2对人体无害,是因为它的含量很少
B.葡萄酒中的SO2具有抗氧化作用,是因为它具有较强的还原性
C.从红葡萄酒的颜色判断,其中的SO2没有漂白性
D.葡萄酒倒入酒杯摇一摇,可以减少其中SO2的含量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:填空题
(本题共12分)含硫化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。回答下列问题:
1.SO2具有还原性,写出将SO2气体通入 FeCl3溶液中的离子方程式,并标出电子转移的数目及方向。______________________________________________________________________
2.在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
4.已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________
常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三下学期第三次质检考试理综化学试卷(解析版) 题型:简答题
(15分)(NH4)2Fe(SO4)2俗称莫尔盐,其常见的制备工艺流程如下:
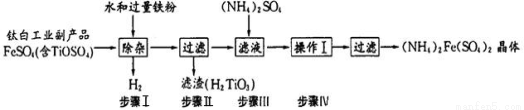
(1)已知流程中铁粉制备反应如下:
4 H2O(g) +3Fe(s) Fe3O4(s)十4H2(g) △H =a kJ /mol
Fe3O4(s)十4H2(g) △H =a kJ /mol
Fe3O4(s) = 3 Fe(s)+ 2O2(g) △H =b kJ/mol
则光解气态水制备H2的热化学方程式为 。
(2)步骤I中加水发生如下反应,请完善该反应: +2H2O  2H++ H2TiO3 ↓;
2H++ H2TiO3 ↓;
该步骤加入铁粉的作用是① ;② 。
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为 ;
写出(NH4)2Fe(SO4)2溶液中各离子溶度由大到小的顺序:
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化。据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是 。
(5)室温时Fe(OH)3的悬浊液中存在Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)=0.08 mol·L-1则溶液的pH等于 。
Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)=0.08 mol·L-1则溶液的pH等于 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com