
【题目】工业制HNO3的过程中排放的NO2和NO常用NaOH溶液吸收,反应的化学方程式为NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,NO不能被NaOH溶液吸收。若同温同压下NO2与NO的体积之比如下,其中不能被NaOH溶液完全吸收的是( )
A.1:1B.1:3C.2:1D.3:1
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物的种类很多,分类依据也很多。![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是七种常见的含硫化合物。某同学按以下思路进行探究:
是七种常见的含硫化合物。某同学按以下思路进行探究:
(1)分类:若按酸、碱、盐、氧化物进行分类,则七种物质中属于盐的共有______种;若将硫元素化合价相同的物质分为一类,则这七种物质可分为______类。
(2)完成下列含硫化合物间的转化,写出相应的化学方程式(试剂可任选)。
![]() :______。
:______。
![]() :______。
:______。
![]() :______。
:______。
(3)为减少![]() 的污染并变废为宝,我国正在探索在一定条件下用
的污染并变废为宝,我国正在探索在一定条件下用![]() 还原
还原![]() 得到单质硫的方法来除去
得到单质硫的方法来除去![]() 。该反应的化学方程式为____________。
。该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个绝热恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是

A. 反应物浓度:a点小于c点
B. 该反应的正反应为放热反应
C. c点达到平衡状态
D. Δt1=Δt2时,H2的产率:a~b段大于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如右图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2g铜。
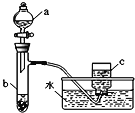
①请写出铜与稀硝酸反应的离子反应方程式_________________________________________。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有__________________________。
③仪器c中收集的气体主要是_______________________。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是______g。
(2)乙组同学对铁与稀硝酸的反应进行探究.他们用amolFe和含有bmolHNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。
①反应结束后的溶液中NO3-的物质的量的取值范围是___________(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+)为3∶1,则b∶a的值为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LNO2完全溶于水,转移电子数为0.5NA
B.20gD2O和HTO两种水的组合中含有的中子数为10NA
C.一定温度下,1molH2和足量碘蒸气反应产生的H-I键数目为2NA
D.标准状况下,22.4L的HF中含有的原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?__________(“是”或“否”),理由是____________________________________________________。
(3)对比试管a、b、c的实验现象,可知pH增大![]() _____(选填“增大”,“减小”,“不变”);
_____(选填“增大”,“减小”,“不变”);
(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-__________CrO42-(填“大于”,“小于”,“不确定”);写出此过程中氧化还原反应的离子方程式_________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1 L FeCl3与CuCl2的混合溶液(其中Cu2+浓度为0.05 mol·L-1)中加入一定量的Fe粉,充分反应后过滤,剩余固体质量为6.0 g,向滤液中加入足量的AgNO3溶液,生成57.4 g沉淀。下列说法正确的是
A.剩余固体为CuB.加入Fe粉的质量为8.4 g
C.原溶液中Fe3+浓度为0.3 mol·L-1D.反应后溶液中Fe2+浓度为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(主要成分为![]() ,其中硫元素为
,其中硫元素为![]() 价)在高温条件下和氧气反应制备
价)在高温条件下和氧气反应制备![]() :
: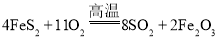 ,该反应中被氧化的元素是______(填元素符号)。当该反应转移
,该反应中被氧化的元素是______(填元素符号)。当该反应转移![]() 电子时,生成的二氧化硫在标准状况下的体积为______
电子时,生成的二氧化硫在标准状况下的体积为______![]() 。
。
(2)实验室中用下列装置测定![]() 被催化氧化为
被催化氧化为![]() 的转化率。(已知
的转化率。(已知![]() 的熔点为
的熔点为![]() ,假设气体进入装置时均被完全吸收,且忽略空气中
,假设气体进入装置时均被完全吸收,且忽略空气中![]() 的影响)
的影响)
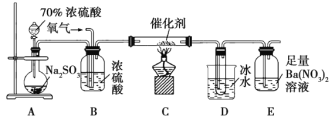
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:______。
②当停止通入![]() ,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置![]() 增加的质量为mg,装置
增加的质量为mg,装置![]() 中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某学习小组设计了如图所示装置来验证二氧化硫的化学性质。
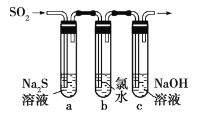
①能说明二氧化硫具有氧化性的实验现象为______。
②为验证二氧化硫的还原性,反应一段时间后,取试管![]() 中的溶液分成三份,分别进行如下实验。
中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入![]() 溶液,有白色沉淀生成
溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
上述方案合理的是______(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管![]() 中发生反应的离子方程式为______。
中发生反应的离子方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com