
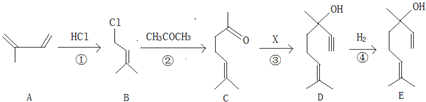
 ,故答案为:
,故答案为: ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
| B、单质硅是将太阳能转化为电能的常用材料 |
| C、PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 |
| D、“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式.利用CO2合成聚碳酸酯类可降低塑料的做法符合“低碳经济”的要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, | |
| 步骤5:往B试管中加入 振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO |
| 乙 | 既有Fe3+又有Fe2+ | 有SO |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
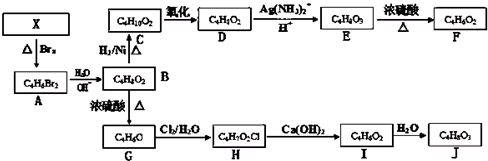
查看答案和解析>>
科目:高中化学 来源: 题型:
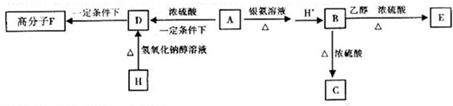
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com