
| 编号 | X | Y | Z |
| ① | N2 | Mg | CO2 |
| ② | FeCl3溶液 | Cu | 浓硝酸 |
| ③ | 氨水 | Al(OH)3 | 稀硫酸 |
| ④ | KOH溶液 | SiO2 | 盐酸 |
| A. | ①② | B. | ①④ | C. | ①②③ | D. | ①②④ |
分析 ①Mg在氮气、二氧化碳中能燃烧;
②Cu与浓硝酸反应生成硝酸铜、二氧化氮与水,与氯化铁溶液反应得到氯化铜、氯化亚铁;
③氢氧化铝是两性氢氧化物,能与强酸、强碱反应;
④二氧化硅不能溶于盐酸.
解答 解:①Mg在氮气燃烧生成氮化镁,Mg在二氧化碳中燃烧生成MgO和C,故①符合;
②常温下,Cu与浓硝酸反应生成硝酸铜、二氧化氮与水,与氯化铁溶液反应得到氯化铜、氯化亚铁,故②符合;
③氢氧化铝是两性氢氧化物,能与强碱氢氧化钠反应生成偏铝酸钠与水,与弱碱不反应,所以与氨水不反应,与稀硫酸反应生成硫酸铝与水,故③不符合;
④二氧化硅能与氢氧化钾反应反应生成硅酸钾与水,在酸中二氧化硅只与HF反应,不能与盐酸反应,故④不符合,
故选A.
点评 本题考查元素化合物性质,难度不大,侧重对基础知识的巩固,需要学生熟练掌握元素化合物性质.


科目:高中化学 来源: 题型:选择题
| A. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 水溶液中Fe2+、H+、SO${\;}_{3}^{2-}$、ClO-不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 用做感光片的溴化银贮存在无色试剂瓶中 | |
| C. | 烧碱溶液放在带磨口玻璃塞的试剂瓶中 | |
| D. | 1mol/L NaCl溶液不能长期保存在容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题:
实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);
;镁条在气体B中燃烧生成的物质是Mg3N2(填化学式);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
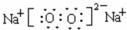 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与S混合加热生成FeS | |
| B. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 | |
| C. | 检验SO2气体中是否含有CO2气体,可将气体先通入饱和碳酸氢钠溶液,再通入品红溶液,最后通入澄清石灰水溶液 | |
| D. | 氯化氢水溶液能导电,所以氯化氢是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +(a+b)kJ•mol-1 | B. | +(a-b)kJ•mol-1 | ||
| C. | +(a+3b)kJ•mol-1 | D. | +(0.5a+1.5b)kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com