
| A. | 过滤 | B. | 电泳 | C. | 渗析 | D. | 分液 |
科目:高中化学 来源: 题型:选择题
| A. | 与水相比,AgCl在Na2CO3溶液中的溶解度及溶度积均增大 | |
| B. | 反应后的溶液中:c(Na+)>c(CO32-)>c(Cl-)=c(Ag+)>c(OH-)>c(H+) | |
| C. | 溶液中c(Cl-)=2×10-5mol•L-1 | |
| D. | 沉淀转化反应;2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为2×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,氢元素含量最高的烃的分子式CH4.
,氢元素含量最高的烃的分子式CH4.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
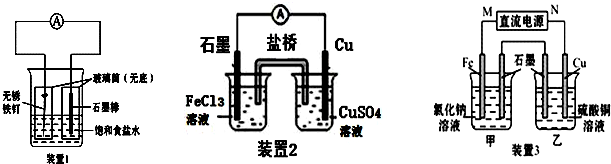
 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与氢气化合比溴与氢气化合容易 | |
| B. | 硒化氢比硫化氢稳定 | |
| C. | 氢氧化锶比氢氧化钙的碱性强 | |
| D. | 铍的原子失电子能力比镁弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的砒霜为1.98mg | B. | 分解产生的氢气为0.672ml | ||
| C. | 转移的电子总数为0.18NA | D. | 和砒霜反应的锌为3.90mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com