
| A、明矾[KAl(SO4)2?12H2O]溶解在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、玻璃具有耐腐蚀性,可以用玻璃试剂瓶长期保存酸、碱溶液 |
| C、浓H2SO4有强氧化性,但常温下可以用铁槽车运输 |
| D、将SO2通入溴水,溴水褪色后加热能恢复原色 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 使用试剂 | 判断方法 |
| ① | 铁粉 | 如果有气泡,表明盐酸已经过量 |
| ② | pH试纸 | 如果pH<7,表明盐酸已经过量 |
| ③ | 硝酸银溶液 | 如果有白色沉淀产生,表明盐酸已经过量 |
| ④ | 紫色石蕊试液 | 如果溶液变成红色,表明盐酸已经过量 |
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
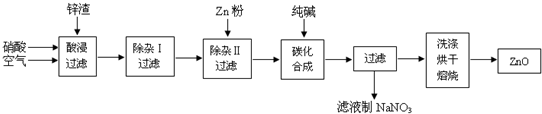
查看答案和解析>>
科目:高中化学 来源: 题型:
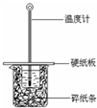 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示. | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.3 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.0 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.6 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
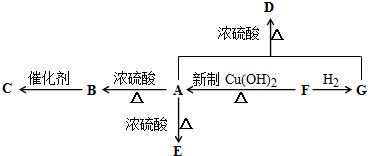
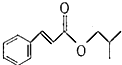 )是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:
)是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:

| 催化剂 |
| H2 |
| 浓H2SO4 |
| 140℃ |
| 浓H2SO4 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com