
【题目】已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-272.0 kJ/mol;
O2(g)=FeO(s) ΔH1=-272.0 kJ/mol;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.7 kJ/mol。
O2(g)=Al2O3(s) ΔH2=-1 675.7 kJ/mol。
Al和FeO发生铝热反应的热化学方程式是______________________。某同学认为,铝热反应可用于工业炼铁,你的判断是________(填“能”或“不能”),你的理由是________________________。
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() 。下列有关说法错误的是
。下列有关说法错误的是
A. 该有机物的分子式为C10H10O2
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 该有机物分子中所有碳原子可能共平面
D. 该有机物能使酸性高锰酸钾溶液和溴水褪色,其褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:①金刚石和C60 ②H、D和T ③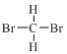 和
和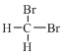 ④CH3(CH2)2CH3和(CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CCH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O。互为同位素的是(填序号,下同)___,互为同素异形体的是______,互为同系物的是_____,属于同分异构体的是_______。
④CH3(CH2)2CH3和(CH3)2CHCH3 ⑤正戊烷和异戊烷 ⑥(CH3)3CCH2CH2CH3和CH3CH2CH2CH2CH3 ⑦H2O、T2O和D2O。互为同位素的是(填序号,下同)___,互为同素异形体的是______,互为同系物的是_____,属于同分异构体的是_______。
(2)①下列分子式仅能表示一种物质的是___________(填序号);
A.C2H4O2 B.C4H8 C.C2H5Cl
②已知C4H9Cl共有四种结构,则分子式为C5H10O的醛应有____________种;
③某有机物的分子式为C3H6O3,其分子结构中含有羧基和羟基,但没有甲基,则该有机物的结构式为 ______。
(3)A~D四种物质皆为烃类有机物,分子球棍模型分别如图所示,请回答下列问题。
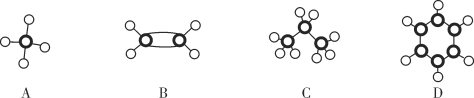
①等物质的量的上述烃,完全燃烧时消耗O2最多的是__________(填字母代号,下同),等质量的上述烃完全燃烧时消耗O2最多的是________。
②在120℃,1.01×105Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是________________。
③B的某种同系物W,分子式为C6H12,且所有碳原子都在同一平面上,则W的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
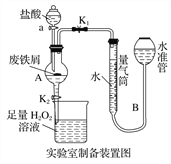
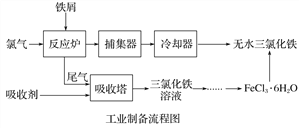
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应。
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸;
Ⅱ.当……时,关闭弹簧夹K1,打开活塞K2,当A中溶液完全进入烧杯后关闭活塞a;
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是_____________________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________。
(3)从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是加入______________后__________________、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:______________________。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对原子质量:Cl-35.5、Fe-56)为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100 mL溶液;取出10.00 mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定终点的现象是________________________________________________;
②样品中氯化铁的质量分数为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是____;上述元素处于同一主族的有____。(用元素符号表示)
(2span>)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式:____。
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①![]() Li和
Li和![]() Li作核反应堆最佳热载体,
Li作核反应堆最佳热载体,![]() LiH和
LiH和![]() LiD用作高温堆减速剂。下列说法正确的是____。
LiD用作高温堆减速剂。下列说法正确的是____。
A.![]() Li和
Li和![]() Li互为同位素 B.
Li互为同位素 B.![]() Li和
Li和![]() Li属于同种核素
Li属于同种核素
C.![]() LiH和
LiH和![]() LiD的化学性质不同 D.
LiD的化学性质不同 D.![]() LiH和
LiH和![]() LiD是同种物质
LiD是同种物质
②下列说法不正确的是____。
A.碱性:Be(OH)2<LiOH<NaOH<KOH
B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+
D.金属性:Cs>Rb>K>Na>Li>Be
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对新制氯水的探究所得出的结论不正确的是( )
A.新制氯水使紫色石蕊先变红后褪色,说明新制氯水中含有![]() 和
和![]()
B.往新制氯水中加入硝酸酸化的![]() 溶液,有白色沉淀产生,说明新制氯水中有
溶液,有白色沉淀产生,说明新制氯水中有![]()
C.将![]() 固体加入新制的氯水中,有气泡产生,说明新制氯水显酸性
固体加入新制的氯水中,有气泡产生,说明新制氯水显酸性
D.将新制氯水置于阳光下,有气泡冒出且溶液颜色逐渐变浅,该气体一定是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组采用如图装置制备高铁酸钾![]() 并探究其性质用途。
并探究其性质用途。
资料:![]() 为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生
为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生![]() ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ![]() 制备
制备![]() 夹持、加热等装置略
夹持、加热等装置略![]()

(1)![]() 中发生反应的化学方程式为________________;B中所用试剂为________________。
中发生反应的化学方程式为________________;B中所用试剂为________________。
(2)C中反应为放热反应,而反应温度须控制在![]() ,可使用的控温方法为________,充分反应后得到紫色固体,反应方程式为________________________。反应中KOH必须过量的原因是________________________。
,可使用的控温方法为________,充分反应后得到紫色固体,反应方程式为________________________。反应中KOH必须过量的原因是________________________。
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用________。
![]() 冰水
冰水 ![]() 溶液
溶液 ![]() 异丙醇
异丙醇
Ⅱ![]() 探究
探究![]() 的性质
的性质
(4)![]() 可以将废水中的
可以将废水中的![]() 氧化为
氧化为![]() ,实验表明,
,实验表明,![]() 时
时![]() 去除效果最佳。配平反应离子方程式:______FeO42-+___________CN-__________H2O→Fe(OH)3↓+_______CNO-_________OH-。_________
去除效果最佳。配平反应离子方程式:______FeO42-+___________CN-__________H2O→Fe(OH)3↓+_______CNO-_________OH-。_________
现处理含![]() 离子浓度为
离子浓度为![]() 的废水
的废水![]() ,至少需要
,至少需要![]() ________g。
________g。
(5)用滴定分析法测定样品中![]() 的纯度:现称取
的纯度:现称取![]() 制备的样品溶于适量氢氧化钾溶液中,加入稍过量的
制备的样品溶于适量氢氧化钾溶液中,加入稍过量的![]() ,充分反应后过滤,滤液定容于250mL容量瓶中。
,充分反应后过滤,滤液定容于250mL容量瓶中。
每次取![]() 加入稀硫酸酸化,用
加入稀硫酸酸化,用![]() 的
的![]() 标准溶液滴定,三次滴定消耗标准溶液的平均体积为
标准溶液滴定,三次滴定消耗标准溶液的平均体积为![]() 。有关反应的离子方程式为:
。有关反应的离子方程式为:
![]() ;
;
![]() ;
;
![]() 。
。
样品中高铁酸钾的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.化学反应能够制造新物质,同时也能制造出新的元素
B.煤在空气中强热得到焦炭、煤焦油、焦炉气、粗氨水等产物的过程叫煤的干馏
C.在酿酒的过程中,葡萄糖可通过水解反应生成酒精
D.工业生产玻璃、水泥、冶炼铁均需要用到石灰石为原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是 ( )
A.①AgNO3;②NaBr;③AgBr B.①AgNO3;②NaCl;③AgCl
C.①AgCl; ②AgNO3;③NaCl D.①AgNO3;②NaCl;③Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com