
高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A 升高温度,逆反应速率减小
B.恒温恒容下,增大压强,H2浓度一定减小
C.反应的焓变为正值
D.该反应化学方程式为CO + H2O CO2+ H2
CO2+ H2
C
解析试题分析:化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据平衡常数的表达式可知,该反应的方程式是CO2+ H2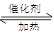 CO + H2O,选项D不正确;恒容时,温度升高,H2浓度减小,这说明升高温度,破坏向正反应方向移动,因此正反应是吸热反应,C正确;升高温度,正逆反应速率均增大,A不正确;反应前后体积不变,则恒温恒容下,增大压强,平衡不移动,H2浓度一定增大,B不正确,答案选C。
CO + H2O,选项D不正确;恒容时,温度升高,H2浓度减小,这说明升高温度,破坏向正反应方向移动,因此正反应是吸热反应,C正确;升高温度,正逆反应速率均增大,A不正确;反应前后体积不变,则恒温恒容下,增大压强,平衡不移动,H2浓度一定增大,B不正确,答案选C。
考点:考查平衡常数的应用、外界条件对平衡状态和反应速率的影响等
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生灵活运用基础知识解决实际问题的能力的培养。明确平衡常数的含义、外界条件对平衡状态和反应速率的影响,是答题的关键。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:单选题
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应,在10 min时达到平衡:PCl3(g)+Cl2(g) PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在反应C(s)+CO2(g)=2CO(g)中,能使反应速率加快的是
①增大压强 ②升高温度 ③将C粉碎 ④通CO2气体 ⑤加入足量木炭粉
| A.①②③ | B.①②④ | C.①②③④ | D.全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关化学反应速率和限度的说法中,不正确的是( )
| A.实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快 |
| B.在金属钠与足量水反应中,增加水的量能加快反应速率 |
C.2SO2+O2 2SO3,反应中,SO2不能全部转化为SO3 2SO3,反应中,SO2不能全部转化为SO3 |
| D.实验室用碳酸钙和盐酸反应抽取CO2,用碳酸钙粉末比块状碳酸钙反应要快 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使放出H2速率加快的是
①升高温度
②改用100mL 1mol/L硫酸
③多用300mL 1mol/L盐酸;
④用等量锌粉代替锌粒
⑤改用100mL 6mol/L硝酸
⑥滴入几滴硫酸铜溶液
⑦用粗锌代替纯锌使用
| A.①③④⑤⑦ | B.①②④⑥⑦ | C.②③④⑤⑥ | D.①②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g) 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
A.若反应开始时容器体积为2L,则Vc=0.4mol?L-1?min-1
B.若在恒压绝热条件下反应,平衡后nc<<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,对于反应mA(g)+nB(g)  pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )
pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )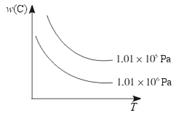
A.ΔH<0,m+n<p+q B.ΔH>0,m+n>p+q
C.ΔH>0,m+n<p+q D.ΔH<0,m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应∶2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)800℃、2L密闭容器反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随
2NO2(g)体系中, n(NO)随
时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 (3) 反应达到平衡状态时NO的转化率= 。(提示 : )
(3) 反应达到平衡状态时NO的转化率= 。(提示 : )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com