
| |||||||||||||||||||||||
(1) |
[解题思路]本题主要考查制取纯硅过程中H2还原SiCl4的实验,解题过程中要充分利用题干所给信息,去考虑装置的设计、优化所应采取的措施.如SiCl4沸点低(57.6),故要使其逸出烧瓶与H2反应,则需对烧瓶B进行水浴加热,,由于H2还原SiCl4的实验是在某些方面1000—1100℃的高温下进行的,在此温度下普通玻璃管会软化,故需用石英玻璃管,由SiCl4易水解生成硅酸和氯化氢,不难想到尾气应通入NaOH溶液中;而H2从A逸出时会带出水蒸气,使B中SiCl4发生水解影响实验,所以可以想到应在A、B之间加一个干燥装置 对装置B水浴加热 |
(2) |
在1000—1100℃时普通玻璃管会软化,SiO2 |
(3) |
B中液面上方产生少量白色烟雾,液体中有少量白色皎状物生成 |
(4) |
NaOH,SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O |
(5) |
在装置A与B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.| A-B | A=B | A≡B | ||
| CO | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kJ?mol-1) | 441.2 273 | |||
| N2 | 键能(kJ?mol-1) | 154.8 | 418.3 | 941.7 |
| 键能差值(kJ?mol-1) | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三上学期第二次月考化学试卷 题型:选择题
甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,他们之间有如下转化关系:
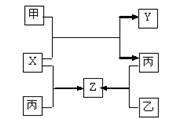
已知甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体。下列说法不正确的是
A.X是具有极性键的非极性分子 B.Z是水煤气的主要成分之一
C.甲和X的反应是吸热反应 D.丙是生产硅的重要原料
查看答案和解析>>
科目:高中化学 来源:2011年福建省福州三中高考化学练习试卷(解析版) 题型:解答题
| A-B | A=B | A≡B | ||
| CO | 键能 | 357.7 | 798.9 | 1071.9 |
| 键能差值 | 441.2 273 | |||
| N2 | 键能 | 154.8 | 418.3 | 941.7 |
| 键能差值 | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,他们之间有如下转化关系:
已知甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体。下列说法不正确的是
A.X是具有极性键的非极性分子 B.Z是水煤气的主要成分之一
C.甲和X的反应是吸热反应 D.丙是生产硅的重要原料
查看答案和解析>>
科目:高中化学 来源:2012届河北省三河一中高三上学期第二次月考化学试卷 题型:单选题
甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,他们之间有如下转化关系: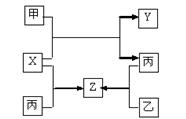
已知甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体。下列说法不正确的是
| A.X是具有极性键的非极性分子 | B.Z是水煤气的主要成分之一 |
| C.甲和X的反应是吸热反应 | D.丙是生产硅的重要原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com