
分析 由反应方程式可知2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,2molNaHCO3分解生成1molNa2CO3、1molH2O和1molCO2,生成的1molH2O和1molCO2会和Na2O2固体反应,CO2先反应,H2O再反应,可采用极值法来讨论计算.
解答 解:加热后,发生反应如下:
①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
2 1 1 1
2mol n(Na2CO3)n(H2O)n(CO2)
n(Na2CO3)=1mol n(H2O)=1mol n(CO2)=1mol
②2Na2Oz+2CO2═2Na2CO3+O2
1 1
③2Na2Oz+2H2O═4NaOH+O2↑
1 1 2
2molNaHCO3分解生成1molNa2CO3、1molH2O和1molCO2,Na2O2固体先和CO2反应,再和H2O反应,
(1)当0<n≤1时,发生①②两个反应,固体的组成成份为:Na2CO3;
(2)当1<n<2时,发生反应①②③,n>1反应②进行完全,反应③已经进行当n=2时反应进行完全,所以此时反应生成的气体为H2O和O2;
(3)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
2 1
2mol n(Na2CO3)n(H2O)n(CO2)
n(Na2CO3)=1mol n(H2O)=1mol n(CO2)=1mol
2Na2Oz+2CO2═2Na2CO3 +O2
2 2 1
1mol n′(Na2CO3)n1(O2 )
2Na2Oz+2H2O═4NaOH+O2↑
2 2 1
1mol n2(O2 )
n′(Na2CO3)=1mol、n1(O2 )=0.5mol、n2(O2 )=0.5mol,所以产生 Na2CO3固体总量为2mol;产生O2 的物质的量为1mol;
故答案为:(1)Na2CO3;(2)H2O和O2;(3)Na2CO3固体总量为2mol;产生O2 的物质的量为1mol.
点评 本题考查了碳酸氢钠的性质及过氧化钠的性质及有关计算,搞清反应原理,找出各量之间的关系是解题的基础,对于范围类的题目,常采用极值法进行计算.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
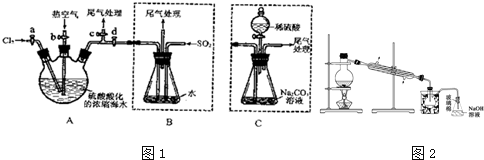
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
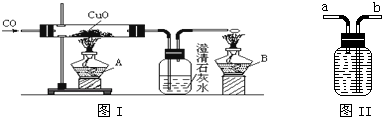
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
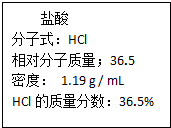 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.| 物质类别 | 含氧强酸 | 碱 | 钠盐 |
| 化学式 | ①H2SO4②HClO4 | ③ ④Mg(OH)2 ④Mg(OH)2 | ⑤NaCl ⑥Na2SO3 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com