
选考题【化学一一选修化学与技术】(15分)以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下:
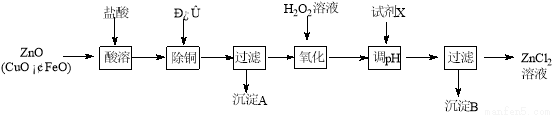
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 1 | 3. 2 |
Zn2+ | 5. 2 | 6. 4 |
Fe2+ | 5. 8 | 8. 8 |
(1)加入H2O2溶液发生反应的离子方程式为 。
(2)流程图中,为了降低溶液的酸度,试剂X不可以是 (选填序号:
a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3 ;d.ZnSO4;pH应调整到 ;
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为 ;
Ⅱ、制取金属锌采用碱溶解ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq),然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ;阴极的电极反应为 ;
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 。
(1)2Fe2+ +H2O2 +2H+ = 2Fe3++2H2O(2分)
(2)d(2分);3.2 ≤ pH < 5.2 (或:约为4) (2分)
(3) (2分);
(2分);  (2分)
(2分)
(4)O2 (或氧气)(1分); [Zn(OH)4]2-+2e-=Zn + 4OH-(2分)
(5)氧化铜、氧化亚铁不溶于碱溶液中
【解析】
试题分析:(1)双氧水具有强氧化性,能把亚铁离子氧化为铁离子,离子方程式为2Fe2+ +H2O2 +2H+ = 2Fe3++2H2O。
(2)由于不能引入杂质,因此X不能选择硫酸锌,答案爱信d;调节pH的目的是沉淀铁离子,而保留锌离子,所以pH应调整到3.2≤pH<5.2;
(3)2分子2-羟基丙酸分子酯化反应生成丙交酯,结构简式为 ;2-羟基丙酸分子中羟基和羧基,发生缩聚反应生成聚乳酸,结构简式为
;2-羟基丙酸分子中羟基和羧基,发生缩聚反应生成聚乳酸,结构简式为 。
。
(4)以石墨作电极电解时,阳极是溶液中的氢氧根离子放电,产生的气体为O2;阴极得到电子,电极反应式为[Zn(OH)4]2-+2e-=Zn + 4OH-;
(5)由于氧化铜、氧化亚铁不溶于碱溶液中而能溶于酸溶液中,所以炼锌烟尘采用碱溶,而不采用酸溶后电解。
考点:考查物质制备工艺流程图的分析与应用


 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2014-2015广东省高二上学期期中联考化学(理)试卷(解析版) 题型:选择题
下列烷烃的命名正确的是
A.2,4-二乙基戊烷 B.4-甲基-3-乙基已烷
C.2-甲基-3-丙基戊烷 D.2,3,3-三甲基戊烷
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:实验题
(15分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置Ⅰ中产生气体的化学方程式为 。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。

实验二 葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列属于放热反应的是
A.生石灰和水 B.碳酸钙高温分解
C.灼热的碳和二氧化碳 D.Ba(OH)2·8H2O晶体和NH4Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
常温常压下,下列气体在水中的溶解度最大的是
A.NH3 B.NO C.Cl2 D.H2
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:选择题
10克Fe2O3、SiO2、Al2O3混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积如图。以下叙述错误的是

A.滤出的物质为SiO2
B.可求出x的值
C.可求出Al2O3的质量分数
D.可求出Fe2O3的质量分数
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:推断题
(共14分)已知化合物A与B、丙与丁的组成元素分别相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温下都会出现钝化现象,加热时有大量气体产生。(相关转化及部分反应条件和生成物未标出)。

(1)A的结构式 , E与F的反应是 (填反应名称),写出2种该反应在工业生产中的用途: 、 。
(2)若反应①除生成甲外,还生成丙,写出过量D与甲的稀溶液反应的离子方程式:
(3)若A与丙可以化合生成甲;D与甲的浓溶液加热条件下可以生成三种化合物乙、丙、B,写出下列化学方程式②: ③:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省协作体高三上学期第二次月考化学试卷(解析版) 题型:选择题
某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是

A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g);△H>0学科网
2C(g);△H>0学科网
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

下列说法不正确的是
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为:2NH3-6e-=N2+6H+
D.当有4.48LNO2(标准状况)被处理时,转移电子为0.8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com