
(15分)在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则

(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为 mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
(15分)(1)正 阳 (各2分)
(2)4OH--4e-===2H2O+O2↑(3分) 56(2分)
(3)0.1 (2分)
(4)A HNO3(各2分)
【解析】
试题分析:(1)甲烧杯中B极增重,说明B极有Ag析出,则B是阴极,所以A是阳极,E是电源的正极,F是电源的负极,D是电解池的阴极,C是电解池的阳极;
(2)甲烧杯是电解硝酸银溶液,所以A极是氢氧根离子放电生成氧气,电极反应式为4OH--4e-===2H2O+O2↑;B极增重1.08g,说明析出Ag的物质的量是0.01mol,转移电子的物质的量是0.01mol,则产生的氧气的物质的量是0.01mol/4=0.0025mol,标准状况下的体积是0.0025mol×22.4L/mol=0.056L=56mL;
(3)乙烧杯是氯化铜溶液,电解氯化铜溶液,阳极的产物是氯气,阴极的产物是Cu,当有0.01mol电子通过时电解CuCl2的物质的量是0.01mol/2=0.005mol,原来溶液中CuCl2的物质的量是0.1L×0.15 mol·L-1=0.015mol,则溶液中还剩余CuCl2的物质的量是0.015-0.005=0.01mol,所以此时溶液的物质的量浓度将变为0.01mol/0.1L=0.1mol/L;
(4)使紫色石蕊试液变红色的物质是酸,A极上是氢氧根离子放电,氢离子浓度增大,酸性增强,所以A及附近的溶液变红;电解硝酸银溶液的总方程式为4 AgNO3+2H2O 4H NO3+O2↑+4Ag,所以最终得到的溶液是硝酸溶液。
4H NO3+O2↑+4Ag,所以最终得到的溶液是硝酸溶液。
考点:考查电解原理的应用,正负极的判断,电极反应式的书写与计算,电极产物的判断


 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol
B.16 g O2和16 g O3含的氧原子个数一样多
C.在标准状况下,水、氧气和氮气分子间的平均距离都相等
D.1 mol氯化钙溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:选择题
标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省高二上学期半期考试化学试卷(解析版) 题型:填空题
(16分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是____反应(填“放热”或“吸热”),该反应的平衡常数表达式为 。
(2)能判断该反应是否达到化学平衡状态的依据是 (填序号)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为 .
A.加压,400~500℃ 催化剂 B.加压,830~1000℃ 催化剂
C.常压,400~500℃ 催化剂 D.常压,830~1000℃ 催化剂
(4)在830 ℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10 min后达到平衡时,CO2的平衡浓度为___________,用H2浓度变化来表示的平均反应速率为____________, CO的转化率是_________。
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是___________(填字母序号).
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省高二上学期半期考试化学试卷(解析版) 题型:选择题
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是 ( )
A. 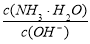 B.
B. 
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第一次月考化学试卷(解析版) 题型:选择题
碘与氢气反应的热化学方程式是
①I2(g)+H2(g) 2HI(g)ΔH=-9.48 kJ·mol-1 ②I2(s)+H2(g)
2HI(g)ΔH=-9.48 kJ·mol-1 ②I2(s)+H2(g) 2HI(g)ΔH=+26.48 kJ·mol-1 下列说法正确的是( )
2HI(g)ΔH=+26.48 kJ·mol-1 下列说法正确的是( )
A.从上述两反应可知1mol的I2(g)能量比1mol的I2(s)能量高
B.I2(s) I2(g) ΔH<0
I2(g) ΔH<0
C.②的反应物总能量与①的反应物总能量相等
D.1 mol I2(g)中通入1 mol H2(g),发生反应时放出的热量为9.48 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第一次月考化学试卷(解析版) 题型:选择题
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做( )
A.正极 B.负极 C.阴极 D.阳极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:选择题
现有H2O、NH3、CH4三种物质,它们分别都含有1mol氢原子,则三种物质的物质的量之比为
A.1∶1∶1 B.6∶4∶3 C.4∶3∶2 D.6∶3∶2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一9月月考化学试卷(解析版) 题型:填空题
(10分) 2 mol O3和3 mol O2的质量之比________,分子数之比________,同温同压的密度之比为________,含氧原子数之比为________,体积之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com