
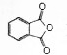
 )在一定条件下可制得酚酞,其分子结构如图所示
)在一定条件下可制得酚酞,其分子结构如图所示 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 上述制酚酞的反应属于取代反应 | |
| B. | 酚酞分子中的碳原子有可能共处于同一平面 | |
| C. | 将酚酞溶于酒精配成的酚酞试剂,滴入中性或酸性水溶液中可能会出现白色浑浊 | |
| D. | 若与NaOH溶液反应,1mol酚酞最多可消耗4molNaOH |
分析 A.有机物中的原子或原子团被其它原子或原子团所取代的反应为取代反应;
B.酚酞中具有甲烷碳原子结构;
C.酚酞中憎水基对溶解度的影响大于亲水基;
D.能和NaOH反应的有酚羟基和酯基水解生成的羧基.
解答 解:A.该反应不是取代反应,故A错误;
B.酚酞中具有甲烷碳原子结构,所以该反应中所有C原子不可能共平面,故B错误;
C.酚酞中憎水基对溶解度的影响大于亲水基,所以将酚酞溶于酒精配成的酚酞试剂,滴入中性或酸性水溶液中可能会出现白色浑浊,故C正确;
D.能和NaOH反应的有酚羟基和酯基水解生成的羧基,所以若与NaOH溶液反应,1mol酚酞最多可消耗3molNaOH,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系、常见反应类型是解本题关键,侧重考查学生分析判断能力,易错选项是D,注意酚酞水解生成的醇羟基和NaOH不反应,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 石油主要含有碳、氢两种元素 | B. | 石油属于可再生矿物能源 | ||
| C. | 石油的裂化是化学变化 | D. | 石油分馏的各馏分均是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用萃取法分离汽油和水的混合液 | |
| B. | 用结晶法提纯NaC1和KNO3混合物中的KN03 | |
| C. | 直接蒸馏酒精溶液得到无水乙醇 | |
| D. | 除去FeC13溶液中少量的FeC12,加入足量的铁屑,充分反应后,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 和C3H6的混合物的质量为a g,所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 标准状况下,2.24 L 2H35Cl 中所含中子数为1.8NA | |
| C. | 50 mL 12 mol•L-1 盐酸与足量MnO2 共热,转移的电子数为0.3NA | |
| D. | 1 L O.lmol•L-1的NaHCO3 溶液中HCO3-和CO32-的离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y的简单气态氢化物的热稳定性比Z的强 | |
| C. | 由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应 | |
| D. | 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
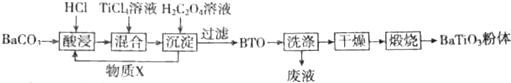
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 测定中和热时,大小两烧杯间填满碎纸的作用只是固定小烧杯 | |
| B. | 用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的中和热相等 | |
| C. | 不能用铜丝代替玻璃棒搅拌酸碱混合液 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 10 | 20 | 25 | 30 |
| 条件A[n(NO2)](mol) | 0.20 | 0.14 | 0.13 | 0.13 | 0.13 |
| 条件B[n(NO2)](mol) | 0.20 | 0.10 | 0.10 | 0.10 | 0.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com